
Assorbanza cos'è, esempi ed esercizi risolti
Il assorbanza è il logaritmo con segno negativo del quoziente tra l'intensità della luce emergente e l'intensità della luce incidente su un campione di soluzione traslucida che è stato illuminato con luce monocromatica. Questo quoziente è il trasmissione.
Viene chiamato il processo fisico del passaggio della luce attraverso un campione trasmissione di luce, e l'assorbanza ne è una misura. Quindi, l'assorbanza diventa il logaritmo minimo della trasmittanza ed è un dato importante per determinare la concentrazione di un campione che è generalmente disciolto in un solvente come acqua, alcool o qualsiasi altro..
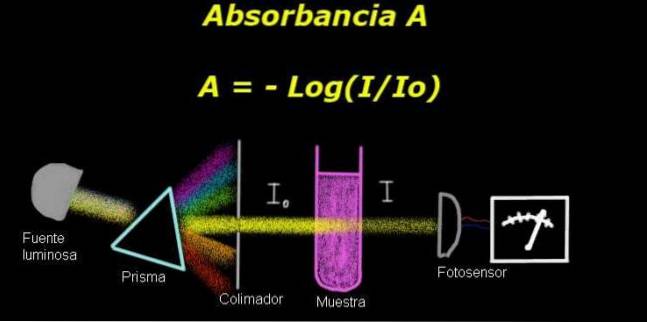
Per misurare l'assorbanza, è necessario un dispositivo chiamato elettrofotometro, con cui si misura una corrente proporzionale all'intensità della luce incidente sulla sua superficie.
Quando si calcola la trasmittanza, di solito viene misurato per primo il segnale di intensità corrispondente al solo solvente e questo risultato viene registrato come Io.
Quindi il campione disciolto viene posto nel solvente nelle stesse condizioni di illuminazione. Il segnale misurato dall'elettro-fotometro è indicato con io, che permette di calcolare la trasmittanza T secondo la seguente formula:
T = I / Io
È una quantità adimensionale. Il assorbanza A è quindi espresso come:
A = - log (T) = - log (I / Io)
Indice articolo
- 1 Assorbanza e assorbimento molare
- 1.1 Legge di Beer-Lambert
- 2 esempi
- 2.1 Esempio 1
- 2.2 Esempio 2
- 3 esercizi risolti
- 3.1 Esercizio 1
- 3.2 Esercizio 2
- 3.3 Esercizio 3
- 4 Riferimenti
Assorbanza e assorbimento molare
Le molecole che compongono una sostanza chimica sono in grado di assorbire la luce e una misura di ciò è proprio l'assorbanza. È il risultato dell'interazione tra fotoni ed elettroni molecolari.
Pertanto, è una grandezza che dipenderà dalla densità o concentrazione delle molecole che compongono il campione e anche dal percorso ottico o dalla distanza percorsa dalla luce..
I dati sperimentali indicano che l'assorbanza PER è linearmente proporzionale alla concentrazione C ea distanza d attraversato dalla luce. Quindi per calcolarlo in base a questi parametri, si può stabilire la seguente formula:
A = ε⋅C⋅d
Nella formula sopra, ε è una costante di proporzionalità nota come assorbimento molare.
L'assorbanza molare dipende dal tipo di sostanza e dalla lunghezza d'onda alla quale viene misurata l'assorbanza. Il assorbimento molare è anche sensibile alla temperatura del campione e al pH del campione.
Legge Beer-Lambert
Questa relazione tra assorbanza, assorbimento, concentrazione e distanza dello spessore del percorso che la luce segue all'interno del campione è nota come legge di Beer-Lambert..

Ecco alcuni esempi di come usarlo.
Esempi
Esempio 1
Durante un esperimento, un campione viene illuminato con luce rossa da un laser a elio-neon, la cui lunghezza d'onda è di 633 nm. Un elettrofotometro misura 30 mV quando la luce laser colpisce direttamente e 10 mV quando passa attraverso un campione..
In questo caso la trasmittanza è:
T = I / Io = 10 mV / 30 mV = ⅓.
E l'assorbanza è:
A = - log (⅓) = log (3) = 0,48
Esempio 2
Se la stessa sostanza viene posta in un contenitore che è la metà dello spessore di quello utilizzato nell'esempio 1, indicare quanto segnerà l'elettro-fotometro, quando la luce del laser elio-neon viene fatta passare attraverso il campione.
Bisogna considerare che se lo spessore diminuisce della metà, allora l'assorbanza proporzionale allo spessore ottico diminuisce della metà, cioè A = 0,28. La trasmittanza T sarà data dalla seguente relazione:
T = 10-A = 10 ^ (- 0,28) = 0,53
L'elettro-fotometro leggerà 0,53 * 30 mV = 15,74 mV.
Esercizi risolti
Esercizio 1
Vogliamo determinare l'assorbività molare di un certo composto brevettato che è in soluzione. Per fare ciò, la soluzione viene illuminata con la luce di una lampada al sodio da 589 nm. Il campione verrà posto in un portacampioni di 1,50 cm di spessore.
Il punto di partenza è una soluzione con una concentrazione di 4,00 × 10 ^ -4 moli per litro e la trasmittanza viene misurata, risultando in 0,06. Utilizzando questi dati, determinare l'assorbività molare del campione..
Soluzione
Innanzitutto, viene determinata l'assorbanza, definita come il logaritmo minimo in base dieci della trasmittanza:
A = - log (T)
A = - log (0,06) = 1,22
Quindi viene utilizzata la legge di Lambert-Beer che stabilisce una relazione tra assorbanza, assorbimento molare, concentrazione e lunghezza ottica:
A = ε⋅C⋅d
Risolvendo per l'assorbività molare, si ottiene la seguente relazione:
ε = A / (C⋅d)
sostituendo i valori dati abbiamo:
ε = 1,22 / (4,00 × 10 ^ -4 M⋅1,5 cm) = 2030 (M⋅cm) ^ - 1
Il risultato di cui sopra è stato arrotondato a tre cifre significative.
Esercizio 2
Per migliorare la precisione e determinare l'errore della misurazione dell'assorbività molare del campione nell'esercizio 1, il campione viene successivamente diluito a metà della concentrazione e la trasmittanza viene misurata in ogni caso..
Partendo da Co = 4 × 10 ^ -4 M con trasmittanza T = 0,06, si ottiene la seguente sequenza di dati per la trasmittanza e l'assorbanza calcolate dalla trasmittanza:
Co / 1-> 0,06-> 1,22
Co / 2-> 0,25-> 0,60
Co / 4-> 0,50-> 0,30
Co / 8-> 0,71-> 0,15
Co / 16-> 0,83-> 0,08
Co / 32-> 0,93-> 0,03
Co / 64-> 0,95-> 0,02
Co / 128-> 0,98-> 0,01
Co / 256-> 0,99-> 0,00
Con questi dati eseguire:
a) Un grafico dell'assorbanza rispetto alla concentrazione.
b) Un adattamento lineare dei dati e trova la pendenza.
c) Dalla pendenza ottenuta, calcolare l'assorbività molare.
Soluzione
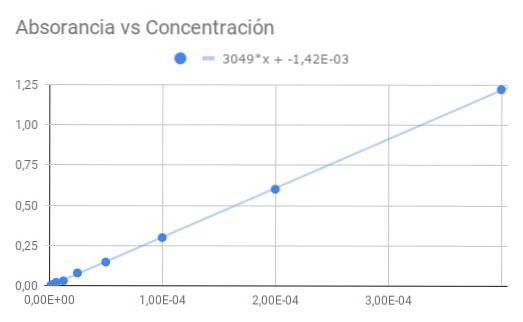
La pendenza ottenuta è il prodotto tra l'assorbività molare e la distanza ottica, quindi dividendo la pendenza per la lunghezza 1,5 cm si ottiene l'assorbività molare
ε = 3049 / 1,50 = 2033 (M⋅cm) ^ - 1
Esercizio 3
Con i dati dell'esercizio 2:
a) Calcola l'assorbività per ogni dato.
b) Determinare un valore medio per l'assorbibilità molare, la sua deviazione standard e l'errore statistico associato alla media..
Soluzione
L'assorbività molare viene calcolata per ciascuna delle concentrazioni testate. Ricorda che le condizioni di illuminazione e la distanza ottica rimangono fisse.
I risultati per l'assorbimento molare sono:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1.872, 1862 in unità di 1 / (M * cm).
Da questi risultati possiamo ricavare il valore medio:
<ε> = 1998 (M * cm) ^ - 1
Con una deviazione standard di: 184 (M * cm) ^ - 1
L'errore medio è la deviazione standard divisa per la radice quadrata del numero di dati, ovvero:
Δ<ε>= 184/9 ^ 0,5 = 60 (M * cm) ^ - 1
Infine, si conclude che la sostanza brevettata ha un assorbimento molare alla frequenza di 589 nm prodotta da una lampada al sodio di:
<ε> = (2000 ± 60) (M * cm) ^ - 1
Riferimenti
- Atkins, P. 1999. Chimica fisica. Edizioni Omega. 460-462.
- La guida. Trasmittanza e assorbanza. Estratto da: quimica.laguia2000.com
- Tossicologia ambientale. Trasmittanza, assorbanza e legge di Lambert. Estratto da: repositorio.innovacionumh.es
- Avventura fisica. Assorbanza e trasmittanza. Estratto da: rpfisica.blogspot.com
- Spettrofotometria. Recupero da: chem.libretexts.org
- Tossicologia ambientale. Trasmittanza, assorbanza e legge di Lambert. Estratto da: repositorio.innovacionumh.es
- Wikipedia. Assorbanza Estratto da: wikipedia.com
- Wikipedia. Spettrofotometria. Estratto da: wikipedia.com



Nessun utente ha ancora commentato questo articolo.