
Proprietà, struttura, usi dell'ossido di cloro (V)
Il ossido di cloro (V) è un composto inorganico altamente instabile la cui formula chimica è ClDueO5. È uno dei tanti ossidi di cloro, caratterizzati dal fatto di essere specie molecolari o addirittura radicali.
Il ClDueO5 Ha trovato vita solo nella carta e nei calcoli teorici; tuttavia la sua esistenza non è stata esclusa ed è probabile che alcuni possano essere caratterizzati (mediante avanzate tecniche di spettroscopia). Ciò che si può prevedere dai concetti di chimica generale di questo ossido è che è l'anidride dell'acido clorico, HClO3.
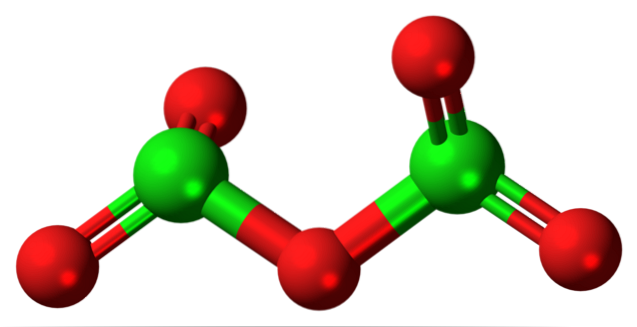
L'ipotetica molecola di ossido di cloro (V) è mostrata sopra. Si noti che poiché si tratta di una molecola, la presenza dello ione Cl non viene considerata affatto+5; ancor meno quando deve avere un tale potere polarizzante da costringere l'ossigeno a legarsi covalentemente.
Come tutti i composti instabili, rilascia energia per scomporsi in prodotti più stabili; processo che in molti casi è esplosivo. Quando il ClDueO5 decompone i rilasci ClODue meDue. Si teorizza che in acqua, a seconda dell'isomero di ClDueO5, può formare vari ossoacidi di cloro.
Indice articolo
- 1 Proprietà
- 2 Struttura dell'ossido di cloro (V)
- 2.1 Molecola
- 2.2 Struttura di Lewis
- 2.3 Isomeri e loro rispettiva idrolisi
- 3 Nomenclatura
- 4 Usi
- 5 Riferimenti
Proprietà
La massa molare di ClDueO5 è 150,9030 g / mol. Da questa massa, e dalla sua ipotetica molecola, si può ipotizzare che se potesse essere isolata sarebbe probabilmente un liquido oleoso; ovviamente, confrontandolo con l'aspetto fisico del ClDueO7.
Sebbene non possa essere isolato o caratterizzato, questo ossido di cloro è acido, covalente e deve anche avere un piccolo momento di dipolo. La sua acidità è comprensibile se si analizza l'equazione chimica della sua idrolisi:
ClDueO5 + HDueO 2HClO3
Essendo l'HClO3 acido clorico. La reazione inversa risulterebbe nel caso in cui l'acido possa essere disidratato:
2HClO3 => ClDueO5 + HDueO
D'altra parte, quando il ClDueO5 appena prodotto, si decompone:
2ClDueO5 => 4ClODue + ODue
È quindi una specie intermedia piuttosto che un ossido propriamente detto. La sua decomposizione deve essere così rapida (considerando che anche ClDueO5), che non è stato rilevato dalle attuali tecniche di analisi strumentale.
Struttura dell'ossido di cloro (V)
Molecola
Nell'immagine in alto è stata mostrata la struttura dell'ipotetica molecola di Cl.DueO5 con un modello di sfere e barre. Le sfere rosse rappresentano gli atomi di ossigeno e le sfere verdi rappresentano gli atomi di cloro. Ogni cloro ha un ambiente piramidale trigonale, quindi la sua ibridazione deve essere sp3.
Quindi, la molecola di ClDueO5 può essere visto come due piramidi trigonali collegate da un ossigeno. Ma se guardi attentamente, una piramide orienta i suoi atomi di ossigeno verso il basso, l'altra fuori dal piano (verso il lettore)..
Quindi si presume che ci siano rotazioni nel collegamento ODueCl-O-ClODue, rendendo la molecola relativamente dinamica. Nota che la formula ODueCHLOClODue è un modo di rappresentare la struttura di ClDueO5.
Struttura di Lewis
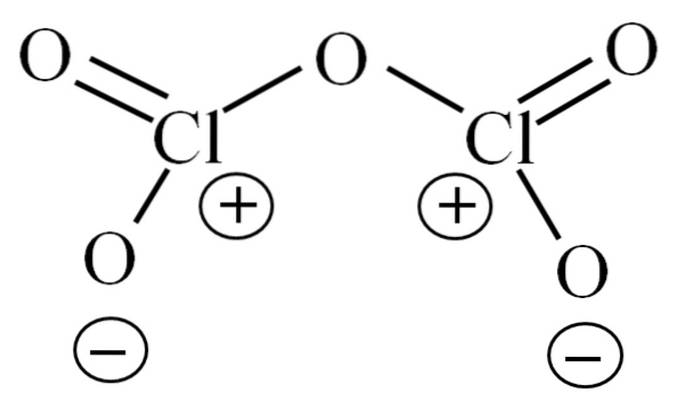
Finora la molecola da sola non ha permesso di decifrare a cosa sia dovuta la sua instabilità. Per far luce su questa domanda, ci rivolgiamo alla sua struttura di Lewis, raffigurata sopra. Si noti che la struttura può essere erroneamente considerata piatta, ma nella sottosezione precedente è stato chiarito che non è così..
Perché entrambi gli atomi di cloro hanno cariche formali positive? Perché il cloro ha una coppia libera di elettroni rimasta, che può essere verificata applicando la teoria del legame di Valencia (che non sarà fatta qui per scopi di semplificazione). Pertanto, il suo carico formale è:
CF = 7 - (4 + 2) = 1
E cosa c'entra questo con la loro instabilità? Ebbene, il cloro è considerevolmente elettronegativo, e quindi un cattivo vettore di cariche formali positive. Questo ritorna al ClDueO5 una specie altamente acida, poiché ha bisogno di guadagnare elettroni per soddisfare la domanda elettronica per i due cloro.
L'opposto accade con il frDueO5 e l'IoDueO5, ossidi che esistono in condizioni normali. Questo perché sia il bromo che lo iodio sono meno elettronegativi del cloro; e quindi, supportano meglio l'accusa formale positiva.
Isomeri e loro rispettiva idrolisi
Finora l'intera spiegazione è ricaduta su uno dei due isomeri di ClDueO5: la ODueCHLOClODue. Qual è l'altro? L'O3CHLOClO. In questo isomero i cloro mancano di cariche positive formali e dovrebbero quindi essere una molecola più stabile. Tuttavia, sia l'ODueCHLOClODue come l'O3ClOClO dovrebbe subire reazioni di idrolisi:
ODueCl-O-ClODue + HDueO => 2ODueCl-OH (che non sono altro che HClO3)
O3Cl-O-ClO + HDueO => O3Cl-OH (HClO4) + HO-ClO (HClODue)
Si noti che si possono formare fino a tre ossoacidi di cloro: HClO3, HClO4 e HClODue
Nomenclatura
Il suo nome "ossido di cloro (V)" corrisponde a quello assegnato in base alla nomenclatura stock. Il ClDueO5 Può anche avere altri due nomi: dicloro pentaossido e anidride clorica, assegnati rispettivamente dalla nomenclatura sistematica e da quella tradizionale..
Applicazioni
Più che motivare studi computazionali, il ClDueO5 Non verrà utilizzato fino a quando non verrà scoperto, isolato, caratterizzato, immagazzinato e mostrato di non esplodere al minimo contatto..
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Sandra Luján Quiroga e Luis José Perissinotti. (2011). Oxoacids di cloro e struttura degli ossidi di dicloruro. Chem. Educator, Vol. 16.
- Formulazione chimica. (2019). Ossido di cloro (V). Estratto da: formulacionquimica.com
- Linus Pauling. (1988). Chimica generale. Dover Publications, INC., New York.
- Richard C. Ropp. (2013). Enciclopedia dei composti alcalini terrosi. Elsevier.



Nessun utente ha ancora commentato questo articolo.