
Struttura, proprietà, usi dell'ossido di cerio (IV)

Il ossido di cerio (IV) L'ossido di u cerico è un solido inorganico bianco o giallo pallido prodotto dall'ossidazione del cerio (Ce) da parte dell'ossigeno alla sua valenza 4+. La formula chimica dell'ossido cerico è CeODue ed è l'ossido più stabile del cerio.
Il cerio (Ce) è un elemento della serie dei lantanidi, che fanno parte del gruppo delle terre rare. La fonte naturale di questo ossido è il minerale bastnasite. Nel concentrato commerciale di questo minerale il CeODue può essere trovato in una proporzione approssimativa fino al 30% in peso.

L'amministratore delegatoDue può essere facilmente ottenuto riscaldando idrossido di cerio (III), Ce (OH) in aria o ossigeno3, o qualsiasi sale di cerio (III), come ossalato, carbonato o nitrato.
L'amministratore delegatoDue Lo stechiometrico può essere ottenuto mediante reazione ad alta temperatura dell'ossido di cerio (III) con l'ossigeno elementare. L'ossigeno deve essere in eccesso e si deve lasciare tempo sufficiente per completare la conversione delle varie fasi non stechiometriche che si stanno formando..
Queste fasi comprendono prodotti multicolori con la formula CeOX (dove x varia tra 1,5 e 2,0). Sono anche chiamati CeO2-x, dove x può avere un valore fino a 0,3. L'amministratore delegatoDue È la forma di Ce più utilizzata nell'industria. Ha una classificazione di bassa tossicità, soprattutto a causa della sua scarsa solubilità in acqua..

Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 durezza Mohs
- 3.3 Peso molecolare
- 3.4 Punto di fusione
- 3.5 Densità
- 3.6 Solubilità
- 3.7 Indice di rifrazione
- 3.8 Altre proprietà
- 4 Usi
- 4.1 - Nell'industria metallurgica
- 4.2 - Nell'industria del vetro
- 4.3 - Negli smalti
- 4.4 - In zirconia ceramica
- 4.5 - Nei catalizzatori per il controllo delle emissioni dei veicoli
- 4.6 - Nella catalisi di reazioni chimiche
- 4.7 - In applicazioni biologiche e biomedicali
- 4.8 - Altri usi
- 5 Riferimenti
Struttura
L'ossido stechiometrico di cerio (IV) cristallizza nel reticolo cubico simile alla fluorite (CaFDue), con 8 O ioniDue- in una struttura cubica coordinata con 4 ioni Ce4+.
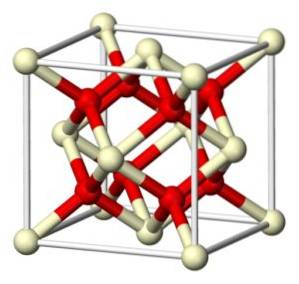
Nomenclatura
- Ossido di cerio (IV).
- Ossido cerico.
- Biossido di cerio.
- Ceria.
- Ossido di cerio stechiometrico: materiale interamente realizzato in CeODue.
- Ossido di cerio non stechiometrico: materiale formato da ossidi misti da CeODue fino al CeO1.5
Proprietà
Stato fisico
Solido giallo pallido. Il colore è sensibile alla stechiometria e alla presenza di altri lantanidi. Gli ossidi non stechiometrici sono spesso blu.
Durezza di Mohs
6-6.1 circa.
Peso molecolare
172,12 g / mol.
Punto di fusione
2600 ºC circa.
Densità
7.132 g / cm3
Solubilità
Insolubile in acqua calda e fredda. Solubile in acido solforico concentrato e acido nitrico concentrato. Insolubile in acidi diluiti.
Indice di rifrazione
2.2.
Altre proprietà
L'amministratore delegatoDue È una sostanza inerte, non viene attaccata da acidi o alcali forti. Tuttavia, può essere sciolto dagli acidi in presenza di agenti riducenti, come il perossido di idrogeno (H.DueODue) o stagno (II), tra gli altri, che generano soluzioni di cerio (III).
Ha un'elevata stabilità termica. Non subisce alterazioni cristallografiche durante i normali intervalli di riscaldamento.
Il suo derivato idratato (CeODue.nHDueO) è un precipitato giallo e gelatinoso che si ottiene trattando soluzioni di cerio (IV) con basi.
L'amministratore delegatoDue è scarsamente assorbito dal tratto gastrointestinale quindi non ha effetti tossici.
Applicazioni
- Nell'industria metallurgica
L'amministratore delegatoDue utilizzato sugli elettrodi di alcune tecnologie di saldatura, come la saldatura ad arco di tungsteno con gas inerte.
L'ossido è finemente disperso in tutta la matrice di tungsteno. A basse tensioni queste particelle CeODue danno maggiore affidabilità rispetto al solo tungsteno.
- Nell'industria del vetro
Lucidatura del vetro
L'ossido di cerio è l'agente lucidante più efficiente per la maggior parte delle composizioni di vetro commerciali. L'amministratore delegatoDue ha quasi completamente sostituito altri ossidi lucidanti, come FeDueO3, silice e ZrODue, grazie alla sua maggiore velocità di lucidatura e pulizia, che aumenta all'aumentare del grado di purezza dell'ossido.
I lucidanti per vetro commerciali a base di polveri di ossido di cerio hanno dimensioni delle particelle definite e disperdibilità controllata in sistemi acquosi..
Il processo di lucidatura del vetro richiede acqua e ciò che viene rimosso o riformato è uno strato superficiale idratato più morbido. L'agente lucidante dovrebbe avere una durezza Mohs di circa 6,5, vicina alla durezza della maggior parte del vetro.
L'ossido di cerio in acqua contiene la coppia Ce (IV) / Ce (III) che con le sue reazioni di ossidoriduzione può fornire assistenza chimica durante la rottura della rete di silicato di vetro.
L'amministratore delegatoDue con un alto grado di purezza viene utilizzato per trattare specchi, televisori, lenti oftalmiche e materiale ottico di precisione.
Scolorimento del vetro
L'amministratore delegatoDue può scolorire il vetro sodico-calcico per bottiglie, brocche e simili. Ce (IV) ossida le impurità Fe (II), che forniscono un colore verde-bluastro, a Fe (III) che dà un colore giallo 10 volte più debole.
Vetro resistente alle radiazioni
L'aggiunta dell'1% di CeODue al glass sopprime lo scolorimento o l'oscuramento del vetro causato dal bombardamento di elettroni ad alta energia negli occhiali TV. Lo stesso vale per il vetro utilizzato nelle finestre delle celle calde nell'industria nucleare, poiché sopprime lo scolorimento indotto dai raggi gamma..
Si ritiene che il meccanismo di soppressione dipenda dalla presenza di ioni Ce4+ e Ce3+ nella rete di vetro.
Occhiali fotosensibili
Alcune formulazioni di vetro possono sviluppare immagini latenti che possono poi essere convertite in una struttura o colore permanente..
Questo tipo di vetro contiene CeODue che assorbe la radiazione UV e rilascia elettroni nella matrice di vetro.
Dopo il trattamento, viene generata la crescita di cristalli di altri composti nel vetro, creando modelli dettagliati per usi elettronici o decorativi..
- In smalti
A causa del suo alto indice di rifrazione, CeODue è un agente opacizzante nelle composizioni di smalto utilizzate come rivestimenti protettivi sui metalli.
La sua elevata stabilità termica e la sua forma cristallografica unica in tutto il range di temperature raggiunte durante il processo di smaltatura, lo rendono idoneo per l'utilizzo negli smalti porcellanati..
In questa applicazione il CeODue Fornisce il rivestimento bianco desiderato durante il burnout dello smalto. È l'ingrediente che fornisce l'opacità.
- In zirconio ceramica
Lo zirconio ceramico è un isolante termico e viene utilizzato in applicazioni ad alta temperatura. Richiede un additivo per avere un'elevata resistenza e tenacità. Aggiunta di CeODue L'ossido di zirconio produce un materiale con eccezionale tenacità e buona resistenza.
Ossido di zirconio drogato con CeODue utilizzato nei rivestimenti per fungere da barriera termica sulle superfici metalliche.
Ad esempio, nelle parti dei motori degli aerei, questi rivestimenti proteggono dalle alte temperature a cui sarebbero esposti i metalli..
- Nei catalizzatori per il controllo delle emissioni dei veicoli
L'amministratore delegatoDue È un componente attivo nella rimozione degli inquinanti dalle emissioni dei veicoli. Ciò è in gran parte dovuto alla sua capacità di immagazzinare o rilasciare ossigeno a seconda delle condizioni circostanti..
Il convertitore catalitico nei veicoli a motore si trova tra il motore e l'uscita dei gas di scarico. Ha un catalizzatore che deve ossidare gli idrocarburi incombusti, convertire CO in CODue, e ridurre gli ossidi di azoto, NOX, tonnellataDue meDue.

Oltre al platino e ad altri metalli catalitici, il principale componente attivo di questi sistemi multifunzionali è il CeODue.
Ogni convertitore catalitico contiene 50-100 g di CeODue finemente suddiviso, che assolve a diverse funzioni. I più importanti sono:
Agisce come stabilizzante per allumina ad alta area superficiale
L'allumina ad alta area superficiale tende a sinterizzare, perdendo la sua elevata area superficiale durante il funzionamento ad alta temperatura. Ciò è ritardato dalla presenza di CeODue.
Si comporta come un tampone di rilascio dell'ossigeno
Grazie alla sua capacità di formare ossidi non stechiometrici CeO2-x, l'ossido di cerio (IV) fornisce ossigeno elementare della propria struttura durante il periodo del ciclo di ossigeno magro / ricco di carburante.
In questo modo può continuare l'ossidazione degli idrocarburi incombusti provenienti dal motore e la conversione della CO in CO.Due, anche quando l'ossigeno gassoso è insufficiente.
Quindi, nel periodo del ciclo ricco di ossigeno, prende l'ossigeno e si ri-ossida, recuperando la sua forma stechiometrica CeODue.
Altri
Funziona come un potenziatore della capacità catalitica del rodio nella riduzione degli ossidi di azoto NOX all'azoto e all'ossigeno.
- Nella catalisi delle reazioni chimiche
Nei processi di cracking catalitico delle raffinerie, CeODue agisce come un ossidante catalitico che aiuta nella conversione di SODue a SO3 e favorisce la formazione di solfati in specifiche trappole del processo.
L'amministratore delegatoDue migliora l'attività del catalizzatore a base di ossido di ferro utilizzato per ottenere lo stirene a partire dall'etilbenzene. Ciò è probabilmente dovuto all'interazione positiva tra le coppie di riduzione dell'ossido Fe (II) - Fe (III) e Ce (III) - Ce (IV).
- In applicazioni biologiche e biomedicali
Sono state trovate nanoparticelle CeODue agiscono eliminando i radicali liberi, come superossido, perossido di idrogeno, radicale ossidrile e ossido nitrico.
Possono proteggere i tessuti biologici dai danni indotti dalle radiazioni, dai danni alla retina indotti dal laser, aumentare la durata della vita delle cellule dei fotorecettori, ridurre le lesioni spinali, ridurre l'infiammazione cronica e promuovere l'angiogenesi o la formazione dei vasi sanguigni.
Inoltre, alcune nanofibre contenenti nanoparticelle CeODue hanno dimostrato di essere tossici contro i ceppi batterici, essendo candidati promettenti per applicazioni battericide.
- Altri usi
L'amministratore delegatoDue È un materiale isolante elettrico grazie alla sua eccellente stabilità chimica, elevata permettività relativa (ha un'alta tendenza a polarizzarsi quando viene applicato un campo elettrico) e un reticolo cristallino simile al silicio..
Ha trovato applicazione nei condensatori e negli strati di smorzamento dei materiali superconduttori.
Viene anche utilizzato in sensori di gas, materiali per elettrodi di celle a combustibile a ossido solido, pompe di ossigeno e monitor di ossigeno..
Riferimenti
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Bailar, J.C.; Emeléus, H.J.; Sir Ronald Nyholm e Trotman-Dickenson, A.F. (1973). Chimica inorganica completa. Volume 4. Pergamon Press.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Volume 5. Quarta edizione. John Wiley & Sons.
- Enciclopedia della chimica industriale di Ullmann. (1990). Quinta edizione. Volume A6. VCH Verlagsgesellschaft mbH.
- Casals, Eudald et al. (2012). Analisi e rischio di nanomateriali in campioni ambientali e alimentari. In chimica analitica completa. Recupero da sciencedirect.com.
- Mailadil T. Sebastian. (2008). Allumina, titania, cerio, silicato, tungstato e altri materiali. Nei materiali dielettrici per la comunicazione wireless. Recupero da sciencedirect.com.
- Afeesh Rajan Unnithan, et al. (2015). Impalcature con proprietà antibatteriche. Nelle applicazioni nanotecnologiche per l'ingegneria dei tessuti. Recupero da sciencedirect.com.
- Gottardi V., et al. (1979). Lucidatura della superficie di un vetro indagata con tecnica nucleare. Bollettino della Società Spagnola di Ceramica e Vetro, Vol. 18, No. 3. Recuperato da boletines.secv.es.



Nessun utente ha ancora commentato questo articolo.