
Biografia, teorie, contributi, opere di Svante August Arrhenius

Svante August Arrhenius (1859-1927) è stato un fisico e chimico svedese noto in tutto il mondo per il suo lavoro nell'area della dissociazione elettrolitica e altre teorie che lo hanno reso un leader mondiale nella ricerca scientifica.
Fu il primo svedese a ricevere il Premio Nobel per la Chimica, scrittore di testi scientifici e riconosciuto come il padre della fisica-chimica; esercitò l'insegnamento universitario e pubblicò ipotesi sull'origine della vita e sulla formazione di stelle e comete.
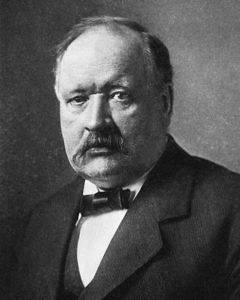
Gli esperti dicono che gli esperimenti di Arrhenius erano in anticipo sui tempi. Un esempio di ciò sono state le sue ricerche sugli agenti causali del riscaldamento globale del pianeta e le sue raccomandazioni per evitare questo grave problema che attualmente colpisce la vita sulla Terra..
Indice articolo
- 1 Biografia
- 1.1 Infanzia e studi
- 1.2 Nuove esperienze
- 2 Teorie
- 2.1 Teoria della dissociazione elettrolitica
- 2.2 Equazione di Arrhenius
- 2.3 Arrhenius e il cambiamento climatico
- 2.4 L'origine della vita e altri contributi
- 3 Funziona
- 4 Ringraziamenti
- 5 Vita personale
- 6 Riferimenti
Biografia
Infanzia e studi
Svante August Arrhenius è nato il 19 febbraio 1859 in una fattoria rustica situata a Vik, in Svezia. Suo padre era Gustav Arrhenius e sua madre Carolina Christina Thunberg.
Fin da giovanissimo fu in contatto con il mondo accademico, poiché suo zio Johann Arrhenius era professore di botanica e successivamente rettore della Scuola di Agraria di Ultuna, mentre suo padre lavorava come geometra presso l'Università di Uppsala.
Con l'obiettivo di migliorare la propria situazione economica, la famiglia si trasferì a Uppsala nel 1860, appena un anno dopo la nascita del piccolo Svante, che fin da giovanissimo si rivelò un prodigio. Si afferma che all'età di tre anni stava già leggendo da solo e risolvendo semplici operazioni matematiche.
Arrhenius studiò alla Uppsala Cathedral School, un campus storicamente prestigioso fondato nel 1246, da cui si laureò nel 1876 con ottimi voti..
All'età di 17 anni è entrato all'Università di Uppsala dove ha studiato matematica, fisica e chimica. Cinque anni dopo si trasferì a Stoccolma per lavorare sotto il professor Erick Edlund (1819-1888) presso l'Accademia reale svedese delle scienze..
Arrhenius inizialmente stava aiutando Edlund con la ricerca, ma presto iniziò a lavorare alla sua tesi di dottorato. Indagini sulla conducibilità galvanica degli elettroliti, che ha presentato nel 1884 all'Università di Uppsala.
Questa ricerca ruotava intorno alla dissoluzione degli elettroliti in soluzioni acquose e alla loro capacità di generare ioni positivi e negativi che conducono l'elettricità. Sfortunatamente, la teoria è stata classificata come errata, quindi la ricerca è stata approvata con un punteggio minimo e contestata dai loro compagni di classe e insegnanti.
Nuove esperienze
Questo rifiuto da parte della comunità scientifica non fermò Arrhenius, che inviò copie della sua tesi a rinomati scienziati come Rudolf Clausius (1822-1888) Julios Lothar Meyer (1830-1895) Wilhem Ostwald (1853-1932) e Jacobus Henricus van 't Hoff. (1852-1811).
Arrhenius ha continuato ad allenarsi e ad imparare dai suoi colleghi. Ha ricevuto una borsa di studio dall'Accademia delle Scienze che gli ha permesso di viaggiare e lavorare in laboratori di importanti ricercatori in luoghi come Riga, Graz, Amsterdam e Lipsia.
Iniziò la sua attività come insegnante nel 1891, insegnando lezioni di Fisica all'Università di Stoccolma. Sei anni dopo, è stato nominato rettore di questo campus di istruzione superiore.
Teorie
Teoria della dissociazione elettrolitica
Durante il suo periodo come professore universitario, Arrhenius ha continuato a lavorare alla ricerca sulle soluzioni acquose discusse nella sua tesi di dottorato. Questa nuova revisione dei suoi dati ed esperimenti servì come base per presentare la sua teoria della dissociazione elettrolitica nel 1889..
Arrhenius ha affermato che un elettrolita era qualsiasi sostanza che, una volta disciolta in una soluzione acquosa, era in grado di condurre una corrente elettrica.
Dopo la dissoluzione, questi elettroliti si dissociarono, generando una carica positiva e una negativa, che chiamò ioni. La parte positiva di questi ioni è stata chiamata catione e anione negativo.
Ha spiegato che la conduttività di una soluzione dipende dalla quantità di ioni concentrati nella soluzione acquosa..
Le soluzioni in cui questi elettroliti sono stati ionizzati sono state classificate come acidi o basi, a seconda del tipo di carica negativa o positiva che si sono formate..
Questi risultati hanno permesso di interpretare il comportamento degli acidi e delle basi fino ad allora conosciuti e hanno dato una spiegazione ad una delle proprietà più importanti dell'acqua: la sua capacità di sciogliere le sostanze.
Questa ricerca lo ha reso degno del Premio Nobel per la Chimica nel 1903, che lo ha consacrato tra i suoi coetanei nazionali e stranieri..
Due anni dopo aver ricevuto questo importante premio, assume la direzione del Nobel Institute for Physical Chemistry, recentemente inaugurato, carica che mantenne fino al suo pensionamento nel 1927.
Equazione di Arrhenius
Arrhenius propose nel 1889 una formula matematica per controllare la dipendenza tra la temperatura e la velocità di una reazione chimica.
Uno studio simile era stato avviato nel 1884 dallo scienziato van't Hoff, ma fu Arrhenius ad aggiungere una giustificazione fisica e l'interpretazione dell'equazione, offrendo un approccio più pratico a questo contributo scientifico..
Un esempio di questo studio si può osservare nella vita di tutti i giorni, quando il cibo viene conservato in frigorifero, dove le basse temperature permettono di rallentare la reazione chimica che ne provoca il deterioramento e quindi è adatto al consumo per un tempo più lungo..
L'equazione di Arrhenius può essere applicata a reazioni gassose omogenee, in soluzione ea processi eterogenei.
Arrhenius e il cambiamento climatico
Più di cento anni fa, quando il riscaldamento globale non era oggetto di dibattito e preoccupazione, Arrhenius stava già iniziando a sollevarlo offrendo previsioni sul futuro della vita sul pianeta..
Nel 1895 si dedicò allo studio del legame tra la concentrazione di anidride carbonica (CODue) nell'atmosfera e nella formazione dei ghiacciai.
Ha concluso che una riduzione del 50% di (CODue) potrebbe significare un calo di 4 o 5 ° C della temperatura del pianeta, che potrebbe generare un raffreddamento massiccio, simile a quello dei periodi glaciali attraverso i quali è passata la terra.
D'altra parte, se questi livelli di CODue aumentato del 50%, si avrebbe un risultato inverso, un aumento della temperatura tra 4 o 5 ° C che provocherebbe un riscaldamento anormale, con conseguenze devastanti per il clima terrestre.
Arrhenius ha anche stabilito che i combustibili fossili e l'incessante attività industriale dell'essere umano sarebbero le cause principali di questo aumento della concentrazione di CODue atmosferico.
I suoi calcoli prevedevano un effetto comprovato sull'equilibrio naturale del nostro pianeta, facendo di Arrhenius il primo uomo a svolgere ricerche formali su questo argomento..
L'origine della vita e altri contributi
Gli argomenti di suo interesse erano molto diversi. Ha offerto contributi nell'area della cosmologia con una teoria sull'origine delle comete che attribuiva la pressione della radiazione solare alla loro formazione; oltre a una teoria sull'evoluzione delle stelle.
Lo studio sull'origine della vita non è stato trascurato da questo scienziato, che nella sua Teoria della Panspermia ha affermato che il germe della vita è sparso in tutto l'universo e che deve solo avere le condizioni necessarie per svilupparsi.
Una teoria molto moderna se si tiene conto che gli scienziati stanno attualmente studiando la presenza di materiale interplanetario nei meteoriti caduti sulla terra e la possibilità che questi siano serviti da veicolo per la prima scintilla di vita sul pianeta.
Arrhenius ha ricevuto nel corso della sua vita molteplici offerte di lavoro da altri paesi, tuttavia ha sempre preferito lavorare in Svezia. Il periodo in cui ha lavorato all'Università della California, negli Stati Uniti, e che ha lasciato il suo libro come risultato, può essere considerato un'eccezione Immunochimica (1907).
Gioca
Arrhenius eccelleva anche come scrittore prolifico, pubblicando opere e discorsi accademici..
- Elettrochimica teorica (1900).
- Trattato di fisica cosmica (1903).
- Teoria della chimica, la terra e l'universo (1906).
- Immunochimica (1907).
- Worlds in Creation: The Evolution of the Universe (1908).
- Leggi quantitative in chimica biologica (1915).
- Il destino delle stelle (1915).
- Chimica e vita moderna (1915).
- Teoria delle soluzioni (1918).
Alcuni testi sono stati scritti esclusivamente per l'approfondimento dello studio e della pratica della chimica, ma ha anche realizzato diverse pubblicazioni di una narrazione di facile interpretazione non solo dalla comunità accademica ma dal grande pubblico..
Ringraziamenti
Il premio più eccezionale che fu assegnato ad Arrhenius fu senza dubbio il Premio Nobel per la Chimica che ricevette nel 1903 grazie alla sua Teoria sulla dissociazione elettrolitica, e che lo rese il primo svedese a meritare tale onore..
Nel 1902, la Royal Society of London (Royal Society) gli conferì la medaglia Davy e quella stessa istituzione lo nominò membro straniero nel 1911.
Nello stesso anno è stato il primo a ricevere la medaglia Willard Gibbs assegnata dall'American Chemical Society.
Nel 1914 ottenne la medaglia di Faraday assegnata dall'Istituto di Fisica del Regno Unito, oltre a una serie di distinzioni e lauree ad honorem offerte da una decina di illustri università europee.
In suo onore sono stati nominati anche il cratere lunare Arrhenius e il cratere Arrhenius di Marte.
Vita privata
Gli storici affermano che Arrhenius era di grande spirito umano. Infatti, durante la prima guerra mondiale si sforzò di aiutare a liberare e rimpatriare gli scienziati che erano stati fatti prigionieri di guerra..
Si sposò due volte, nel 1884, con Sofia Rudbeck, sua studentessa e assistente dalla quale ebbe un figlio. Ventuno anni dopo il suo primo matrimonio, sposò María Johansson, avendo tre figli..
Ha lavorato instancabilmente fino alla sua morte a Stoccolma il 2 ottobre 1927 all'età di 68 anni..
Riferimenti
- Bernardo Herradon. (2017). Arrhenius, uno dei padri della chimica moderna. Tratto da principia.io
- Elisabeth Crawford. (2015). Svante Arrhenius, chimico svedese. Tratto da Britannica.com
- Miguel Barral. (2019). Svante Arrhenius, L'uomo che ha previsto il cambiamento climatico. Tratto da bbvaopenmind.com
- Miguel G. Corral (2011) Le meteoriti potrebbero far esplodere l'inizio della vita. Tratto da elmundo.es
- Svante Arrhenius. Tratto da newworldencyclopedia.org
- Francisco Armijo de Castro. (2012). Cento anni di acque minerali medicinali. Due idrologi: Antoine Lavoisier e Svante Arrhenius. Tratto da magazines.ucm.es


Nessun utente ha ancora commentato questo articolo.