
Effetti di sostituzione nucleofila aromatica, esempi
Il sostituzione nucleofila aromatica (SNAr) è una reazione che si verifica nella chimica organica, che consiste nello spostamento di un buon gruppo uscente da parte di un nucleofilo in arrivo. Dal punto di vista del suo meccanismo e degli aspetti elettronici, è il lato opposto della sostituzione elettrofila aromatica (SEAr).
Generalmente, il gruppo uscente è un alogeno, che esce come anione X alogenuro-. Questa reazione può avvenire solo se l'anello aromatico (principalmente benzene) è carente di elettroni; cioè, se ha gruppi sostituenti che ritirano gli elettroni.

L'immagine in alto delinea quanto detto nel paragrafo precedente. Il gruppo attrattore di elettroni EWG (per il suo acronimo in inglese: Gruppo di ritiro di elettroni), attiva l'anello aromatico per l'attacco nucleofilo della specie negativa Nu-. Si può vedere che si forma un intermedio (al centro), dal quale viene rilasciato o esce l'alogenuro X.-.
Si noti che in termini semplici X è sostituito da Nu in un anello aromatico. Questa reazione è molto versatile e necessaria nella sintesi di nuovi farmaci, così come negli studi di chimica organica sintetica..
Indice articolo
- 1 Aspetti generali
- 1.1 Differenze con la sostituzione elettrofila aromatica
- 2 Effetti
- 2.1 Del numero di sostituenti
- 2.2 Dal gruppo uscente
- 3 Esempio
- 3.1 Commento finale
- 4 Riferimenti
Caratteristiche generali
L'anello aromatico può essere "caricato" o "scaricato" di elettroni a seconda di quali sono i suoi sostituenti (quelli che sostituiscono il legame C-H originale).
Quando questi sostituenti possono donare densità elettronica all'anello, si dice che lo arricchiscano di elettroni; Se, al contrario, sono attrattori di densità elettronica (l'EWG di cui sopra), allora si dice che impoveriscono l'anello di elettroni.
In entrambi i casi l'anello si attiva per una specifica reazione aromatica, mentre è disattivato per l'altro..
Ad esempio, si dice che un anello aromatico ricco di elettroni sia attivo per la sostituzione aromatica elettrofila; cioè, può donare i suoi elettroni a una specie elettrofila, E.+. Tuttavia, non donerà elettroni a una specie Nu-, poiché le cariche negative si respingerebbero a vicenda.
Ora, se l'anello è povero di elettroni, non ha modo di darli alla specie E.+ (SEAr non si verifica); d'altra parte, ha la disponibilità ad accettare gli elettroni della specie Nu- (viene sviluppato lo SNAr).
Differenze con la sostituzione elettrofila aromatica
Una volta chiariti gli aspetti generali di input, è ora possibile elencare alcune differenze tra SNAr e SEAr:
- L'anello aromatico agisce come un elettrofilo (carente di elettroni) e viene attaccato da un nucleofilo.
- Sul ring viene sostituito un gruppo uscente X; non un H.+
- Non si formano carbocationi, ma intermediari con carica negativa delocalizzabili per risonanza
- La presenza di più gruppi attrattori nell'anello accelera la sostituzione invece di rallentarla
- Infine, questi gruppi non hanno effetti direzionali su dove (su quale carbonio) avverrà la sostituzione. La sostituzione avverrà sempre sul carbonio attaccato al gruppo uscente X.
L'ultimo punto è anche illustrato nell'immagine: il legame C-X si rompe per formare il nuovo legame C-Nu.
Modifica effetti
Del numero di sostituenti
Naturalmente, più l'anello è povero di elettroni, più veloce è l'rSNA e meno drastiche sono le condizioni necessarie affinché si verifichi. Considera il seguente esempio rappresentato nell'immagine sottostante:
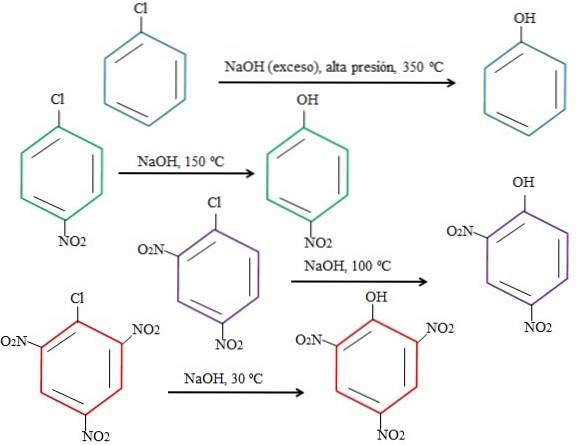
Si noti che il 4-nitroclorobenzene (anello blu) richiede condizioni drastiche (alta pressione e una temperatura di 350 ºC) affinché avvenga la sostituzione di Cl con OH. In questo caso, il cloro è il gruppo uscente (cl-) e idrossido il nucleofilo (OH-).
Quando viene visualizzato il gruppo NODue, che è un attrattore di elettroni (anello verde), la sostituzione può essere effettuata ad una temperatura di 150 ° C a pressione ambiente. All'aumentare del numero di gruppi NODue presente (anelli viola e rossi), la sostituzione avviene a temperature sempre più basse (rispettivamente 100ºC e 30ºC).
Pertanto, i gruppi NON lo sonoDue accelera l'rSNA e priva l'anello di elettroni, rendendolo più suscettibile agli attacchi OH-.
Le posizioni relative di Cl rispetto a NO non verranno qui spiegate.Due nel 4-nitroclorobenzene e come questi alterano la velocità di reazione; Ad esempio, le velocità di reazione del 2-nitroclorobenzene e del 3-nitroclorobenzene sono diverse, essendo quest'ultimo il più lento rispetto agli altri isomeri.
Dal gruppo uscente
Riprendendo il 4-nitroclorobenzene, la sua reazione di sostituzione è più lenta rispetto alla sua controparte fluorurata:
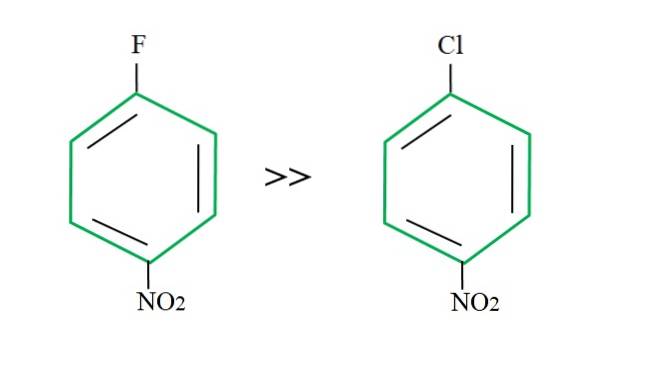
La spiegazione di ciò non può risiedere in nessun'altra variabile che la differenza tra F e Cl. Il fluoro è un terribile gruppo uscente, poiché il legame C-F è più difficile da rompere del legame C-Cl. Pertanto, la rottura di questo legame non è il passo determinante della velocità per lo SNAr, ma l'aggiunta del Nu- all'anello aromatico.
Poiché il fluoro è più elettronegativo del cloro, l'atomo di carbonio ad esso collegato presenta una maggiore deficienza elettronica (C.δ+-Fδ-). Di conseguenza, il carbonio del legame C-F è molto più suscettibile di essere attaccato da Nu- rispetto a quella dell'obbligazione C-Cl. Questo è il motivo per cui la sostituzione di F per OH è molto più rapida di quella di Cl per OH.
Esempio
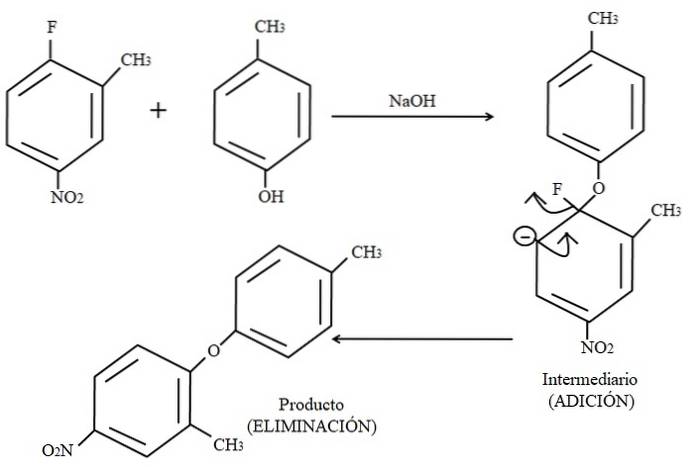
Infine, un esempio di questo tipo di reazioni organiche è mostrato sotto nell'immagine sopra. Il para-cresolo non sembra essere un nucleofilo; ma poiché esiste un mezzo di base, il suo gruppo OH è deprotonato, lasciandolo come un anione fenossido, che attacca il 2-metil-4-nitrofluorobenzene.
Quando si verifica questo attacco, si dice che il nucleofilo si aggiunga all'elettrofilo (l'anello aromatico del 2-metil-4-nitrofluorobenzene). Questo passaggio è visibile a destra dell'immagine, dove si forma il composto intermedio con entrambi i sostituenti appartenenti all'anello.
Quando viene aggiunto il para-cresolo, appare una carica negativa che viene delocalizzata dalla risonanza all'interno dell'anello (notare che smette di essere aromatica).
Nell'immagine è mostrata solo l'ultima struttura di risonanza, dalla quale il fluoro termina come F-; ma in realtà detta carica negativa viene delocalizzata anche negli atomi di ossigeno del gruppo NODue. Dopo la fase di aggiunta viene la fase di eliminazione, l'ultima, che è quella in cui il prodotto è finalmente formato.
Commento finale
Il gruppo NODue residuo può essere ridotto al gruppo NHDue, e da lì è possibile effettuare più reazioni di sintesi per modificare la molecola finale. Ciò evidenzia il potenziale sintetico dell'rSNA e che il suo meccanismo consiste anche in due fasi: una per l'addizione e l'altra per l'eliminazione..
Attualmente, tuttavia, esistono prove sperimentali e computazionali che la reazione procede effettivamente secondo un meccanismo concordato, in cui entrambi i passaggi avvengono simultaneamente attraverso un complesso attivato e non un intermedio..
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Wikipedia. (2019). Sostituzione aromatica nucleofila. Estratto da: en.wikipedia.org
- James Ashenhurst. (06 settembre 2019). Sostituzione nucleofila aromatica (NAS). Estratto da: masterorganicchemistry.com
- Chemistry LibreTexts. (05 giugno 2019). Sostituzione aromatica nucleofila. Recupero da: chem.libretexts.org



Nessun utente ha ancora commentato questo articolo.