
Formule di solfuro di sodio, usi, rischi
Il solfuro di sodio (Na2S) è un solido cristallino dal giallo al rosso mattone. In natura si trova in diversi gradi di idratazione, il più comune è il solfuro di sodio nonaidrato (Na2S 9H2O).
Sono sali idrosolubili che danno soluzioni fortemente alcaline. Se esposti all'aria umida, assorbono l'umidità dall'aria, potendosi riscaldare spontaneamente e provocare l'accensione dei materiali combustibili vicini. Allo stesso modo, a contatto con l'aria umida, emettono acido solfidrico, che odora di uova marce..

Sono forti agenti riducenti. Queste sostanze possono essere pericolose per l'ambiente, soprattutto per gli organismi acquatici.
Il monosolfuro di sodio viene fornito in commercio in forma di scaglie contenente 60-62% di NaDueS ...
- Formule

- CAS: 1313-82-2 Sodio solfuro (anidro)
- CAS: 1313-84-4 Sodio solfuro (nonaidrato)
Struttura 2D
Struttura 3D

Caratteristiche del solfuro di sodio
Proprietà fisiche e chimiche

Il monosolfuro di sodio (Na2S) cristallizza con la struttura antifluorito, in cui ogni atomo di S è circondato da un cubo di 8 atomi di Na e ogni atomo di Na da un tetraedro con 4 atomi di S..
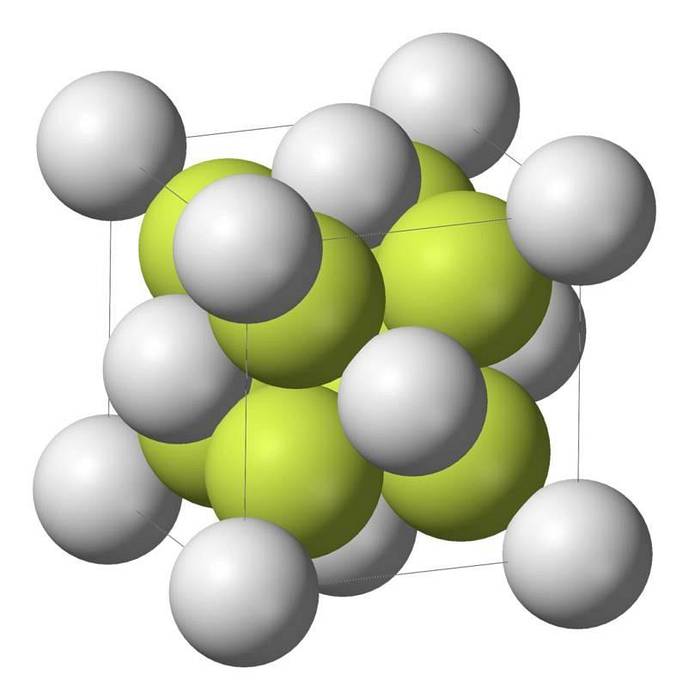
Infiammabilità
L'unico membro altamente infiammabile del gruppo solfuro inorganico è l'idrogeno solforato. Tuttavia, alcuni altri solfuri inorganici, come il solfuro di sodio, possono riscaldarsi spontaneamente e persino incendiarsi se esposti all'umidità..
Se esposto al fuoco, il solfuro di sodio rilascia gas o vapori di anidride solforosa, che sono irritanti o tossici.
Reattività
- I solfuri inorganici sono generalmente basici (alcuni sono fortemente basici, e quindi incompatibili con gli acidi).
- Molti di questi composti sono agenti riducenti (reagiscono vigorosamente con agenti ossidanti).
- I semplici sali di solfuro (come sodio, potassio e solfuro di ammonio) reagiscono vigorosamente con gli acidi per rilasciare gas di idrogeno solforato altamente tossico e infiammabile..
- Il solfuro di sodio è infiammabile. Può esplodere se riscaldato rapidamente o colpire.
- Quando riscaldato fino alla decomposizione, emette fumi tossici di ossido di sodio e ossidi di zolfo.
- Reagisce violentemente con carbonio, carbone, sali di diazonio, N, N-diclorometilammina, forti ossidanti e acqua.
Tossicità
Molti dei membri del gruppo del solfuro inorganico si comportano come basi forti e possono causare gravi ustioni a contatto con la pelle..
Questa proprietà dipende dalla sua solubilità. I solfuri inorganici più insolubili (ad esempio, solfuro di mercurio (II) e solfuro di cadmio) non sono caustici.
Il solfuro di sodio ha un coefficiente di ripartizione ottanolo / acqua medio (Pow) (di -3,5). Questo valore viene utilizzato come misura della solubilità (e bioconcentrazione) di una sostanza nei tessuti grassi animali (soprattutto animali acquatici)..
Il solfuro di sodio è considerato pericoloso per l'ambiente, soprattutto per gli organismi acquatici.
Applicazioni
In casa, il solfuro di sodio viene utilizzato in detergenti per scarichi, detergenti per la casa (per il forno, il bagno), piastre per capelli, sapone per lavastoviglie e airbag per automobili..
Nell'industria viene utilizzato nei detergenti, nel cemento e come precursore nella produzione di altri prodotti chimici.
Effetti clinici
L'esposizione al solfuro di sodio è comune nei paesi sviluppati e sottosviluppati, sia nell'industria che a casa. Queste sostanze corrosive sono presenti in vari prodotti per la casa a basse concentrazioni..
Nei paesi sviluppati, gli effetti gravi sono rari. Questi si verificano principalmente dall'ingestione deliberata della sostanza chimica negli adulti. Tuttavia, nei paesi in via di sviluppo, gli effetti gravi sono più comuni.
I corrosivi alcalini causano necrosi da liquefazione. Saponificano i grassi nella membrana cellulare, distruggendo la cellula e permettendo una penetrazione profonda nel tessuto mucoso.
Esposizione orale
L'infiammazione iniziale si verifica nel tessuto gastrointestinale, seguita da necrosi tissutale (con possibile perforazione), quindi granulazione e infine formazione di stenosi.
I pazienti con lieve ingestione sviluppano irritazione o ustioni di grado I (iperemia superficiale ed edema) dell'orofaringe, dell'esofago o dello stomaco..
I pazienti con intossicazione moderata possono sviluppare ustioni di grado II (vesciche superficiali, erosioni e ulcerazioni) con possibile successiva formazione di stenosi (in particolare esofagee)..
Alcuni pazienti (soprattutto i bambini piccoli) possono sviluppare edema delle vie respiratorie superiori.
I pazienti con grave intossicazione per ingestione possono sviluppare ustioni profonde e necrosi della mucosa gastrointestinale, con complicazioni quali: perforazione (esofagea, gastrica, raramente duodenale), formazione di fistole (tracheoesofageo, aortoesofageo) e sanguinamento gastrointestinale..
Può sviluppare: ipotensione, tachicardia, tachipnea, formazione di stenosi (principalmente esofageo), carcinoma esofageo ed edema delle vie respiratorie superiori (che è comune e spesso pericoloso per la vita).
L'intossicazione grave è generalmente limitata all'ingestione intenzionale negli adulti.
Esposizione per inalazione
Una lieve esposizione può causare tosse e broncospasmo.
L'inalazione grave può causare edema delle vie respiratorie superiori, ustioni, stridore e, raramente, lesioni polmonari acute..
Esposizione oculare
Può causare grave irritazione congiuntivale e chemosi, difetti dell'epitelio corneale, ischemia limbica, perdita della vista permanente e nei casi gravi di perforazione.
Esposizione cutanea
Una lieve esposizione provoca irritazione e ustioni a spessore parziale. L'acidosi metabolica può svilupparsi in pazienti con gravi ustioni o shock..
L'esposizione prolungata o prodotti ad alta concentrazione possono causare ustioni a tutto spessore.
Sicurezza e rischi
Indicazioni di pericolo del Sistema mondiale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS)
Il sistema globale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS) è un sistema concordato a livello internazionale, creato dalle Nazioni Unite e progettato per sostituire i vari standard di classificazione ed etichettatura utilizzati nei diversi paesi utilizzando criteri coerenti a livello globale..
Le classi di pericolo (e il relativo capitolo GHS), gli standard di classificazione ed etichettatura e le raccomandazioni per il solfuro di sodio sono i seguenti (Agenzia europea per le sostanze chimiche, 2017; Nazioni Unite, 2015; PubChem, 2017):







Riferimenti
- Benjah-bmm27, (2006). Fluorite-unit-cell-3D-ionic [immagine] Estratto da: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [immagine] Estratto da: chem.nlm.nih.gov.
- ChemIDplus, (2017). Struttura 3D di 1313-82-2 - Solfuro di sodio [immagine] Estratto da: chem.nlm.nih.gov.
- ChemIDplus, (2017). Struttura 3D di 1313-84-4 - Solfuro di sodio [immagine] Estratto da: chem.nlm.nih.gov.
- Agenzia europea per le sostanze chimiche (ECHA). (2017). Riepilogo della classificazione e dell'etichettatura.
- Classificazione armonizzata - Allegato VI del Regolamento (CE) n. 1272/2008 (Regolamento CLP). Solfuro di sodio. Estratto il 16 gennaio 2017 da: echa.europa.eu.
- Agenzia europea per le sostanze chimiche (ECHA). (2017). Riepilogo della classificazione e dell'etichettatura.
- Classificazione ed etichettatura notificate. Solfuro di sodio, idratato. Estratto il 16 gennaio 2017 da: echa.europa.eu.
- Banca dati sulle sostanze pericolose (HSDB). TOXNET. (2017). Solfuro di sodio. Bethesda, MD, UE: Biblioteca nazionale di medicina. Recupero da: toxnet.nlm.nih.gov.
- Lange, L. e Triebel, W. (2000). Solfuri, polisolfuri e sulfani. Nell'Enciclopedia della chimica industriale di Ullmann. Wiley-VCH Verlag GmbH & Co. KGaA. Recuperato da dx.doi.org.
- Nazioni Unite (2015). Sesta edizione riveduta del sistema globale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS). New York, UE: pubblicazione delle Nazioni Unite. Estratto da: unece.org.
- Centro nazionale per le informazioni sulla biotecnologia. Database composto di PubChem. (2016). Solfuro di sodio enneaidrato - Struttura PubChem [immagine] Estratto da: pubchem.ncbi.nlm.nih.gov.
- Centro nazionale per le informazioni sulla biotecnologia. Database composto di PubChem. (2017). Monosolfuro di sodio. Bethesda, MD, UE: Biblioteca nazionale di medicina. Estratto da: pubchem.ncbi.nlm.nih.gov.
- Centro nazionale per le informazioni sulla biotecnologia. Database composto di PubChem. (2017). Solfuro di sodio enneaidrato. Bethesda, MD, UE: Biblioteca nazionale di medicina. Estratto da: pubchem.ncbi.nlm.nih.gov.
- Amministrazione nazionale oceanica e atmosferica (NOAA). CAMEO Chemicals. (2017). Scheda tecnica chimica. Sodio solfuro, anidro. Silver Spring, MD. UNIONE EUROPEA; Estratto da: cameochemicals.noaa.gov.
- Amministrazione nazionale oceanica e atmosferica (NOAA). CAMEO Chemicals. (2017). Scheda tecnica Reactive Group. Solfuri, inorganici. Silver Spring, MD. UNIONE EUROPEA; Estratto da: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [immagine] Estratto da: wikipedia.org.
- PubChem, (2016). Monosolfuro di sodio [immagine] Estratto da: puchem.nlm.nih.gov.
- PubChem, (2016). Solfuro di sodio enneaidrato [immagine] Estratto da: puchem.nlm.nih.gov.
- Wikipedia. (2017). Coefficiente di ripartizione ottanolo-acqua. Estratto il 17 gennaio 2017 da: wikipedia.org.
- .



Nessun utente ha ancora commentato questo articolo.