
Struttura, proprietà, usi del solfuro di rame

Il solfuro di rame è una famiglia di composti inorganici la cui formula chimica generale è CuXSY. sì X È più grande di Y significa che detto solfuro è più ricco di rame che di zolfo; e se al contrario, X È più piccolo di Y, allora lo zolfo è più ricco di zolfo del rame.
Numerosi minerali predominano in natura, rappresentando le fonti naturali di questo composto. Quasi tutti sono più ricchi di rame che di zolfo e la loro composizione è espressa e semplificata dalla formula CuXS; Qui X può anche assumere valori frazionari, indicativi di un solido non stechiometrico (Cu1.75S, ad esempio).

Sebbene lo zolfo sia giallo nel suo stato elementare, i suoi composti derivati appaiono di colore scuro; questo è anche il caso del solfuro di rame. Tuttavia, la covelite minerale (immagine in alto), composta principalmente da CuS, mostra lucentezza metallica e iridescenza bluastra..
Possono essere preparati da diverse fonti di rame e zolfo, utilizzando tecniche differenti e variando i parametri di sintesi. In questo modo è possibile ottenere nanoparticelle CuS con morfologie interessanti.
Indice articolo
- 1 Struttura del solfuro di rame
- 1.1 Collegamenti
- 1.2 Coordinazioni nella covelita
- 1.3 Altri cristalli
- 2 Proprietà
- 2.1 Generale
- 2.2 Covelite
- 3 usi
- 3.1 Nanoparticelle in medicina
- 3.2 Nanoscienza
- 4 Riferimenti
Struttura del solfuro di rame
Collegamenti
Questo composto ha l'aspetto di essere cristallino, quindi si può immediatamente pensare che sia composto da ioni Cu+ (rame monovalente), CuDue+ (rame bivalente), SDue- e, compreso, SDue- e SDueDue- (anioni disolfuro), che interagiscono tramite forze elettrostatiche o legami ionici.
Tuttavia, esiste un leggero carattere covalente tra Cu e S, e quindi il legame Cu-S non può essere escluso. Da questo ragionamento, la struttura cristallina del CuS (e quella di tutti i suoi solidi derivati) comincia a differire da quelle trovate o caratterizzate per altri composti ionici o covalenti..
In altre parole, non si può parlare di ioni puri, ma al centro delle loro attrazioni (cationi anioni) c'è una leggera sovrapposizione dei loro orbitali esterni (condivisione di elettroni).
Coordinazioni in la covelita
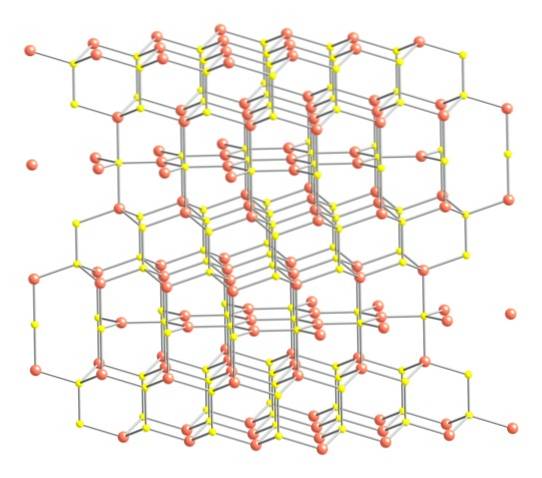
Detto questo, la struttura cristallina della covelite è mostrata nell'immagine in alto. È costituito da cristalli esagonali (definiti dai parametri delle loro celle unitarie), dove gli ioni si uniscono e si orientano in diverse coordinate; questi sono, con un numero vario di vicini stretti.
Nell'immagine, gli ioni rame sono rappresentati da sfere rosa, mentre gli ioni zolfo sono rappresentati da sfere gialle..
Focalizzando l'attenzione prima sulle sfere rosa, si noterà che alcune sono circondate da tre sfere gialle (coordinazione del piano trigonale), e altre da quattro (coordinazione tetraedrica)..
Il primo tipo di rame, trigonale, è individuabile nei piani perpendicolari alle facce esagonali rivolte verso il lettore, in cui si trovano a loro volta il secondo tipo di carbonio, tetraedrico.
Passando ora alle sfere gialle, alcune hanno cinque sfere rosa come vicine (coordinazione trigonale bipiramidale), e altre tre e una sfera gialla (ancora, coordinazione tetraedrica); In quest'ultimo, si vede l'anione disolfuro, che può essere visto sotto e all'interno della stessa struttura della covelite:
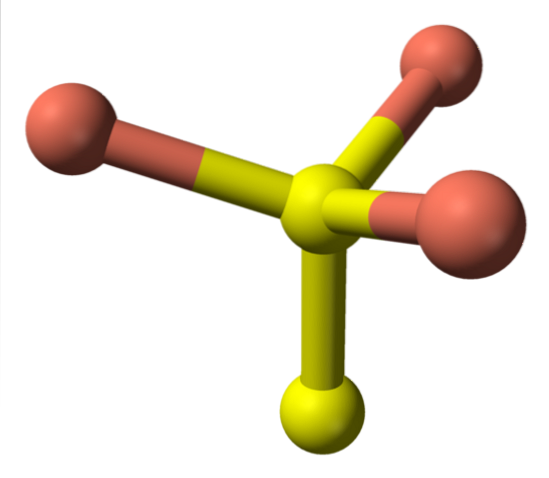
Formula alternativa
Ci sono poi ioni CuDue+, Cu+, SDue- e SDueDue-. Tuttavia, studi effettuati con la spettroscopia fotoelettronica a raggi X (XPS), indicano che tutto il rame è come cationi Cu+; e quindi, la formula iniziale CuS, è espressa "meglio" come (Cu+)3(S2−) (SDue)-.
Si noti che il rapporto Cu: S per la formula precedente continua a essere 1 e inoltre le spese vengono annullate.
Altri cristalli
Un solfuro di rame può adottare cristalli ortorombici, come nel polimorfo, γ-CuDueS, da calcocite; cubico, come in un altro polimorfo di calcocite, α-CuDueS; tetragonale, nell'anilite minerale, Cu1.75S; monoclinics, nella djurleita, Cu1.96Sì, tra gli altri.
Per ogni cristallo definito c'è un minerale e, a sua volta, ogni minerale ha le sue caratteristiche e proprietà.
Proprietà
Generale
Le proprietà del solfuro di rame sono soggette al rapporto Cu: S dei suoi solidi. Ad esempio, quelli con anioni SDueDue- hanno strutture esagonali e possono essere semiconduttori o conduttori metallici.
Se invece il contenuto di zolfo è costituito solo da anioni SDue-, i solfuri si comportano come semiconduttori e mostrano anche conduttività ioniche ad alte temperature. Questo perché i suoi ioni iniziano a vibrare e a muoversi all'interno dei cristalli, trasportando così cariche elettriche..
Otticamente, sebbene dipenda anche dalla loro composizione di rame e zolfo, i solfuri possono o meno assorbire la radiazione nella regione dell'infrarosso dello spettro elettromagnetico. Queste proprietà ottiche ed elettriche ne fanno potenziali materiali da implementare in diverse gamme di dispositivi..
Un'altra variabile da considerare, oltre al rapporto Cu: S, è la dimensione dei cristalli. Non solo ci sono più solfuri di rame “zolfo” o “ramati”, ma le dimensioni dei loro cristalli conferiscono un effetto impreciso sulle loro proprietà; Pertanto, gli scienziati sono ansiosi di studiare e cercare applicazioni per le nanoparticelle di Cu.XSY.
Covelite
Ogni solfuro di rame o minerale ha proprietà uniche. Tuttavia, di tutte, la covelite è la più interessante dal punto di vista strutturale ed estetico (per via delle sue iridescenze e dei toni del blu). Pertanto, alcune delle sue proprietà sono menzionate di seguito.
Massa molare
95,611 g / mol.
Densità
4,76 g / mL.
Punto di fusione
500 ° C; ma si rompe.
Solubilità dell'acqua
3.3 10-5 g / 100 mL a 18ºC.
Applicazioni
Nanoparticelle in medicina
Non solo la dimensione delle particelle varia fino a raggiungere dimensioni nanometriche, ma anche la loro morfologia può variare notevolmente. Pertanto, il solfuro di rame può formare nanosfere, barre, piastre, film sottili, gabbie, cavi o tubi..
Queste particelle e le loro attraenti morfologie acquisiscono applicazioni individuali in diversi campi della medicina..
Ad esempio, nanogabbie o sfere vuote possono fungere da trasportatori di farmaci all'interno del corpo. Sono state utilizzate nanosfere, supportate da elettrodi di vetro al carbonio e nanotubi di carbonio, per funzionare come rilevatori di glucosio; così come i suoi aggregati sono sensibili alla rilevazione di biomolecole come il DNA.
I nanotubi CuS superano le nanosfere nel rilevamento del glucosio. Oltre a queste biomolecole, gli immunosensori sono stati progettati da sottili pellicole CuS e alcuni supporti per la rilevazione di agenti patogeni..
I nanocristalli e gli aggregati amorfi di CuS possono persino causare l'apoptosi delle cellule tumorali, senza causare danni alle cellule sane.
Nanoscience
Nella sottosezione precedente si diceva che le sue nanoparticelle facevano parte di biosensori ed elettrodi. Oltre a tali usi, scienziati e tecnici hanno anche sfruttato le sue proprietà per progettare celle solari, condensatori, batterie al litio e catalizzatori per reazioni organiche molto specifiche; Elementi indispensabili nella nanoscienza.
Vale anche la pena ricordare che, se supportato su carbone attivo, il set NpCuS-CA (CA: Activated Carbon e Np: Nanoparticles) si è dimostrato utile come rimuovi coloranti dannosi per l'uomo e, quindi, funziona come purificatore di fonti di acqua che assorbe molecole indesiderate.
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Solfuro di rame. Estratto da: en.wikipedia.org
- Ivan Grozdanov e Metodija Najdoski. (Millenovecentonovantacinque). Proprietà ottiche ed elettriche dei film di solfuro di rame di composizione variabile. Journal of Solid State Chemistry Volume 114, Issue 2, 1 febbraio 1995, Pages 469-475. doi.org/10.1006/jssc.1995.1070
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Solfuro di rame (CuS). Database PubChem. CID = 14831. Estratto da: pubchem.ncbi.nlm.nih.gov
- Peter A. Ajibade e Nandipha L. Botha. (2017). Proprietà di sintesi, ottiche e strutturali
- di nanocristalli di solfuro di rame da precursori di singole molecole. Dipartimento di Chimica, Università di Fort Hare, Borsa privata X1314, Alice 5700, Sud Africa. Nanomateriali, 7, 32.
- Collaborazione: Autori ed editori dei volumi III / 17E-17F-41C (s.f.). Solfuri di rame (Cu2S, Cu (2-x) S) struttura cristallina, parametri reticolari. In: Madelung O., Rössler U., Schulz M. (eds) Non-Tetrahedrally Bonded Elements and Binary Compounds I. Landolt-Börnstein- Group III Condensed Matter (Numerical Data and Functional Relationships in Science and Technology), vol 41C. Springer, Berlino, Heidelberg.
- Momtazan, F., Vafaei, A., Ghaedi, M. et al. Coreano J. Chem. Eng. (2018). Applicazione di nanoparticelle di solfuro di rame caricate con carbone attivo per l'adsorbimento simultaneo di coloranti ternari: metodologia della superficie di risposta. 35: 1108. doi.org/10.1007/s11814-018-0012-1
- Goel, S., Chen, F. e Cai, W. (2014). Sintesi e applicazioni biomediche di nanoparticelle di solfuro di rame: dai sensori alla teranostica. Piccolo (Weinheim an der Bergstrasse, Germania), 10 (4), 631-645. doi: 10.1002 / smll.201301174



Nessun utente ha ancora commentato questo articolo.