
Proprietà, tipi, esempi di sistemi termodinamici

UN sistema termodinamico o la sostanza di lavoro è una parte dell'universo che viene scelta per essere studiata dalla termodinamica. Questa è una definizione molto ampia, perché un sistema termodinamico può essere vasto come una galassia o può essere una piccola quantità di gas contenuta in un cilindro..
Tutto ciò che circonda il sistema termodinamico, compresa la massa e lo spazio, è il suo ambiente o ambiente. Non si tratta del resto dell'universo, ma solo dell'ambiente in grado di influenzare il sistema.
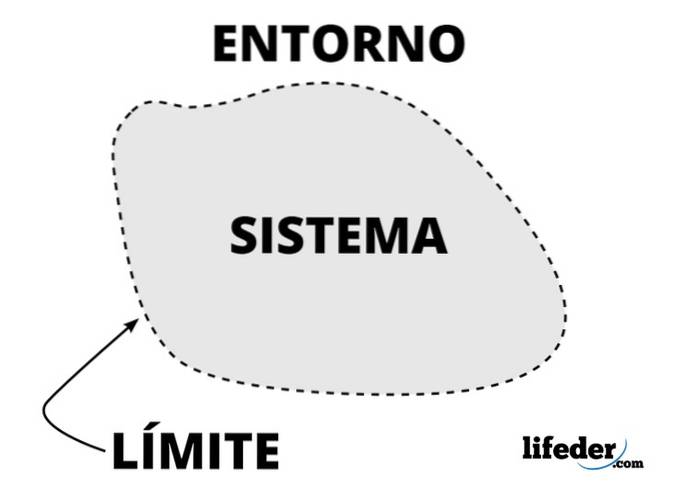
In un sistema termodinamico, lo scambio di massa o energia tra il sistema e l'ambiente circostante è possibile, a seconda del tipo di sistema, essendo l'ambiente in cui si trovano gli osservatori che lo studiano.
Nell'analisi di un sistema termodinamico è importante stabilire il frontiere (confini o muri), che possono essere fissi o mobili. Un barattolo di vetro o metallo ha pareti fisse, ma uno stantuffo o un pistone ha pareti mobili..
In quanto tale, il confine può essere una superficie reale o immaginaria, ma idealmente ha spessore zero, una certa rigidità e altre caratteristiche descritte matematicamente..
I confini immaginari sono necessari quando si studiano sistemi che fanno parte di sistemi molto più grandi, come una stella in una nebulosa..
Gli scambi di calore tra il sistema e l'ambiente circostante, se presenti, sono gli obiettivi primari della termodinamica. Ecco perché ai muri che consentono lo scambio viene dato un nome speciale: adiabatici, mentre quelli che non lo consentono e isolano il sistema sono diatermici..
Indice articolo
- 1 Tipi di sistemi termodinamici
- 1.1 Sistemi aperti
- 1.2 Sistemi chiusi
- 1.3 Sistemi isolati
- 1.4 Sistemi omogenei e sistemi eterogenei
- 2 Esempi di sistemi termodinamici
- 2.1 Contenitore immerso in acqua
- 2.2 Cottura a tegame scoperto
- 2.3 Motore a combustione interna
- 2.4 Caffè o tè in un thermos
- 2,5 uova
- 2.6 Celle
- 2.7 In scatola
- 2.8 Scaldabagno
- 3 Riferimenti
Tipi di sistemi termodinamici
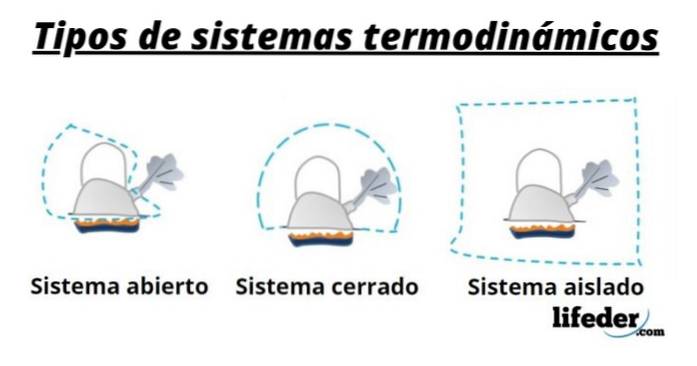
Esistono diversi tipi di sistemi termodinamici, che vengono classificati in base alla loro capacità di scambiare materia ed energia con l'ambiente, in questo modo abbiamo:
Sistemi aperti
Lo scambio di materia ed energia con l'esterno è consentito, per questo vengono anche chiamate controllare il volume.
Molti sistemi ingegneristici sono modellati in questo modo, ad esempio scaldabagni domestici e radiatori per auto..
Sistemi chiusi
Sono anche conosciuti come massa di controllo e sono caratterizzati perché non c'è scambio di materia con l'ambiente. Quindi la sua massa è fissa, tuttavia l'energia può attraversare il suo limite, sia come calore che come lavoro. In questo modo il volume del sistema può variare.
Sistemi isolati
Si tratta di sistemi chiusi in cui viene impedito lo scambio di calore, lavoro o qualsiasi forma di energia con l'ambiente.
Sistemi omogenei e sistemi eterogenei
I sistemi descritti sono stati classificati in base alla loro capacità di scambio con l'ambiente, ma questo non è l'unico criterio. I sistemi termodinamici possono anche essere omogenei ed eterogenei.
Le sostanze pure sono buoni esempi di sistemi omogenei, come il sale da cucina conservato nella saliera. Al contrario, una combinazione di acqua liquida e vapore acqueo è un sistema eterogeneo, poiché si tratta di due stati diversi, le cui proprietà differiscono.
Esempi di sistemi termodinamici
Come abbiamo visto, i sistemi termodinamici vanno dal più semplice al più complesso. Tuttavia, quando li si studia, è conveniente definirli attentamente e cercare di trovare tutti i modi per semplificare l'analisi..
Vediamo alcuni esempi di sistemi reali che ci accompagnano nella vita di tutti i giorni:
Contenitore immerso in acqua

Questo è un sistema termodinamico molto semplice e illustrativo e anche un buon modo per preparare il cibo. Il contenuto del contenitore, siano esse uova, un impasto per uno sformato o qualsiasi altra preparazione, è il sistema termodinamico, mentre il bagnomaria costituisce l'ambiente o l'ambiente.
Durante il riscaldamento dell'acqua, il calore fluisce nel sistema attraverso il confine del contenitore.
La velocità di cottura del cibo dipende da diversi fattori, uno dei quali è il materiale della padella: se è ceramica o metallo. Sappiamo che il metallo è un buon conduttore di calore, quindi ci aspettiamo che il contenuto si riscaldi rapidamente se viene utilizzata una pentola di acciaio o alluminio..
Invece di riscaldare il sistema, potresti voler raffreddare, ad esempio riscaldare un biberon di latte per bambini che è stato surriscaldato. In questo caso il sistema trasferisce il calore al bagnomaria.
Cucinare in una padella scoperta

La cucina è un luogo eccellente per trovare processi termodinamici. Una salsa, un pollo o un altro alimento cotto in padella aperta è un esempio di sistema aperto, poiché lì sono consentiti tutti i tipi di scambio con l'ambiente: aggiungere condimenti, altri ingredienti e modificare il calore aggiunto.
Motore a combustione interna
Nel motore a scoppio di auto, moto, aeroplani e imbarcazioni è presente una miscela di gas (aria) e carburante che si prepara nel carburatore e viene portata al cilindro, dove per effetto della combustione diventa una miscela di gas vari.
Poiché la composizione della miscela varia durante il ciclo di lavoro, si tratta di un sistema termodinamico complesso ed eterogeneo.
Caffè o tè in un thermos

Il caffè o il tè rimangono caldi più a lungo in un thermos. È un contenitore con pareti isolanti, proprio per evitare che il nostro sistema - la bevanda calda - ceda il suo calore all'ambiente e lo raffreddi.
In realtà un thermos sono due contenitori, tra i quali viene realizzato un vuoto parziale per evitare la presenza di un mezzo come l'aria, che aiuta a condurre il calore dall'interno all'esterno del contenitore..
Certo, il thermos funziona anche al contrario, serve a mantenere le bevande fredde più a lungo.
Uova
Le uova che consumiamo come cibo sono ottimi esempi di sistemi termodinamici chiusi, ma permettono lo scambio di energia con l'ambiente. Il guscio d'uovo permette al calore della gallina di schiudere l'embrione, così come il passaggio dei gas.
Cellule
La cellula è l'unità fondamentale degli esseri viventi ed è un sistema termodinamico meravigliosamente efficiente. Per estensione, qualsiasi essere vivente può anche essere considerato un complesso sistema termodinamico.
La membrana cellulare che riveste le strutture interne come il nucleo e i mitocondri è il confine tra il sistema e l'ambiente. Ciò consente lo scambio di energia, l'arrivo dei nutrienti dall'esterno e l'uscita dei rifiuti.
In scatola
I cibi in scatola sono tipici esempi di sistemi termodinamici chiusi.
Scaldabagno
L'acqua all'interno del riscaldatore è un sistema termodinamico aperto, poiché è necessario consentire al calore di raggiungere l'acqua, solitamente da una resistenza elettrica che viene riscaldata, se il riscaldatore è elettrico, oppure tramite l'energia solare o la fiamma che proviene da un accendino gas.
Riferimenti
- Borgnakke. 2009. Fondamenti di termodinamica. 7a edizione. Wiley and Sons.
- Cengel, Y. 2012. Termodinamica. 7a edizione. Mcgraw hill.
- Energia solare. Sistemi termodinamici. Estratto da: solar-energy.net.
- Wikipedia. Sistemi termodinamici. Estratto da: es.wikipedia.org.
- Wikipedia. Sistema termodinamico. Estratto da en.wikipedia.org.



Nessun utente ha ancora commentato questo articolo.