
Reazione di saponificazione e sostanze ottenibili

Il saponificazione è l'idrolisi di base di un estere. Ciò significa che l'estere reagisce con una base (NaOH o KOH) in modo irreversibile, producendo alcol e carbossilati di sodio o di potassio. La parola significa "fare il sapone" e, infatti, è una delle più antiche reazioni chimiche usate dall'umanità..
In epoca babilonese, con l'aiuto delle ceneri raccolte dal legno, dalle piante e dai grassi animali, perfezionarono l'arte della saponeria. Perché il grasso animale? Il motivo è perché è ricco di triesteri di glicerolo (trigliceridi) e la cenere di legno è una fonte di potassio, il metallo di base.
In caso contrario, la reazione continua con una resa inferiore, ma sufficiente per riflettere i suoi effetti sulle vernici e su alcune superfici. Questo è il caso dei colori ad olio, dove i pigmenti sono mescolati con olio (fonte di esteri).
Indice articolo
- 1 Reazione di saponificazione
- 1.1 Meccanismo
- 1.2 Cinetica
- 2 Sostanze che possono essere ottenute per saponificazione
- 2.1 Azione solvente dei saponi
- 3 Riferimenti
Reazione di saponificazione
Meccanismo
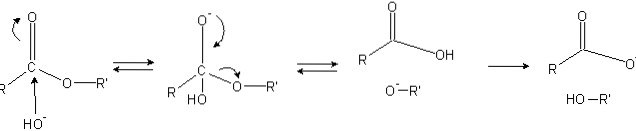
Gli esteri hanno un gruppo acile (O = C-R), che è suscettibile agli attacchi nucleofili come OH-.
Poiché gli atomi di ossigeno "rubano" la densità elettronica all'atomo di carbonio, è parzialmente caricato positivamente, ancor di più nel caso degli esteri.
Di conseguenza, questa carica positiva attrae specie negative in grado di fornire elettroni all'atomo di carbonio, provocando un attacco nucleofilo (il lato sinistro dell'immagine). Di conseguenza, si forma un intermedio tetraedrico (la seconda molecola da sinistra a destra).
La carica negativa sull'ossigeno dell'intermedio tetraedrico è il prodotto di un OH- circostante. Questa carica negativa viene quindi delocalizzata per dare origine al gruppo carbonile, quindi "forzando" la rottura del legame C-OR '. Allo stesso modo, questa delocalizzazione produce un acido carbossilico RCOOH e uno ione alcossido R'O-.
Infine, poiché il mezzo di reazione è basico, l'alcossido deprotona una molecola d'acqua e l'acido carbossilico reagisce con un altro OH.- il mezzo, generando i prodotti di saponificazione.
Cinetica
La velocità della reazione di saponificazione è proporzionale alle concentrazioni dei reagenti. In altre parole, aumentando o la concentrazione dell'estere (RCOOR ') o della base (NaOH), la reazione procederà più velocemente.
Questo si traduce anche come segue: il tasso di saponificazione è del primo ordine rispetto all'estere e del primo ordine rispetto alla base. Quanto sopra può essere espresso con la seguente equazione matematica:
Velocità = k [RCOOR '] [NaOH]
Dove k è la costante o il coefficiente di velocità, che varia in funzione della temperatura o della pressione; cioè, maggiore è il calore, maggiore è il tasso di saponificazione. Per questo motivo il mezzo viene bollito.
Poiché entrambi i reagenti sono del primo ordine cinetico, la reazione complessiva è del secondo ordine.
Nel meccanismo di reazione di saponificazione, la formazione dell'intermedio tetraedrico richiede un attacco nucleofilo, che coinvolge sia l'estere che la base..
Quindi, la cinetica del secondo ordine si riflette in questo fatto, perché intervengono nella fase determinante (lenta) della reazione.
Sostanze che possono essere ottenute per saponificazione

I principali prodotti della saponificazione sono gli alcoli e i sali degli acidi carbossilici. In mezzo acido si ottengono i rispettivi RCOOH, ottenuti dalla saponificazione di grassi e oli, noti come acidi grassi.
Pertanto, i saponi sono costituiti da sali degli acidi grassi prodotti dalla saponificazione. Esci con quali cationi? Possono essere Na+, K+, MgDue+, Fede3+, eccetera.
Questi sali sono solubili in acqua, ma vengono precipitati per azione del NaCl aggiunto alla miscela, che disidrata il sapone e lo separa dalla fase acquosa. La reazione di saponificazione per un trigliceride è la seguente:
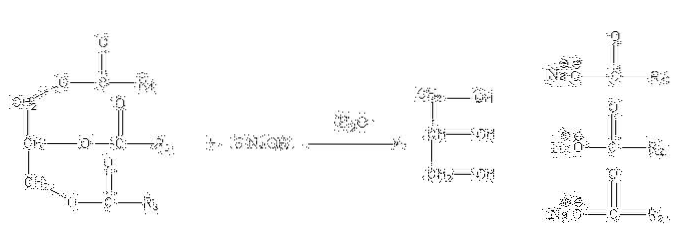
La glicerina è la "E" alcolica e il sapone è tutti i sali degli acidi grassi risultanti. Qui, ciascuna catena laterale -R ha lunghezze e gradi di insaturazione differenti. Di conseguenza, queste catene fanno la differenza tra grassi e oli vegetali.
La chiave per la produzione di saponi risiede quindi nella selezione dei migliori grassi e oli, o più specificamente, nella selezione di diverse fonti di trigliceridi..
Questa massa bianca saponosa può contenere nella sua struttura coloranti e altri composti organici, conferendole aromi piacevoli e colori brillanti. Da qui, la gamma di possibilità è domata dall'arte e dalla vocazione in questo mestiere..
Tuttavia, la reazione di saponificazione è anche una via sintetica di acidi carbossilici e alcoli che non hanno necessariamente a che fare con glicerina o saponi..
Ad esempio, l'idrolisi basica di qualsiasi estere, come il semplice acetato di etile, produrrà acido acetico ed etanolo..
Azione solvente dei saponi

I sali di acidi grassi sono solubili in acqua, ma non nello stesso modo in cui gli ioni sono solvatati; cioè, circondato da una sfera acquosa. Nel caso dei saponi, le loro catene laterali -R ne impediscono teoricamente la dissoluzione in acqua.
Pertanto, per contrastare questa posizione energeticamente scomoda, sono orientate in modo tale che queste catene entrino in contatto, formando un nucleo organico apolare, mentre le teste polari, l'estremo (-COO- N / A+), interagiscono con le molecole d'acqua e creano un "guscio polare".
Quanto sopra è illustrato nell'immagine in alto, dove è mostrato questo tipo di struttura nota come micella.
Le "code nere" corrispondono alle catene idrofobe, aggrovigliandosi in un nucleo organico protetto dalle sfere grigie. Queste sfere grigie compongono la corazza polare, le teste -COO- N / A+.
Quindi, le micelle sono gruppi (agglomerati) di sali di acidi grassi. Al loro interno possono contenere grasso, insolubile in acqua per il suo carattere non polare..
Come lo fanno? Entrambe le catene grasse e -R sono idrofobiche, quindi entrambe hanno un'elevata affinità l'una per l'altra.
Quando le micelle racchiudono i grassi, l'acqua interagisce con il guscio polare, consentendo la solubilità del sapone. Allo stesso modo, le micelle sono caricate negativamente, provocando repulsioni reciproche e, quindi, generando la dispersione dei grassi..
Riferimenti
- Anne Marie Helmenstine, Ph.D. (3 ottobre 2017). Definizione e reazione di saponificazione. Estratto il 24 aprile 2018 da: thoughtco.com
- Francis A. Carey. Chimica organica. Acidi carbossilici. (sesta ed., pagine 863-866). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Chimica organica. Lipidi (10a edizione, pagine 1056-1058). Wiley plus.
- Wikipedia. (2018). Saponificazione. Estratto il 24 aprile 2018 da: en.wikipedia.org
- Boyd C. (27 febbraio 2015). Comprendi la chimica e la storia del sapone. Estratto il 24 aprile 2018 da: chemservice.com
- Luca Laghi. (27 marzo 2007). Saponificazione. Estratto il 24 aprile 2018 da: commons.wikimedia.org
- Amanda Crochet. (12 maggio 2015). Micelle (scala di grigi). Estratto il 24 aprile 2018 da: commons.wikimedia.org



Nessun utente ha ancora commentato questo articolo.