
Struttura, proprietà, usi e sintesi del salicilato di metile

Il salicilato di metile È una sostanza chimica, di natura organica, considerata il composto con la più alta tossicità tra i salicilati conosciuti, nonostante il suo aspetto incolore e un odore gradevole con un leggero tocco dolce. Questa specie è meglio conosciuta con il nome di olio di wintergreen.
È allo stato liquido in condizioni standard di temperatura e pressione (25 ° C e 1 atm), costituendo un estere organico che si trova naturalmente in un'ampia varietà di piante. Dall'osservazione e dallo studio della sua produzione in natura è stato possibile procedere alla sintesi del metil salicilato.

Questa sintesi è stata effettuata mediante una reazione chimica tra l'estere dell'acido salicilico e la sua combinazione con il metanolo. In questo modo, questo composto fa parte di salvia, vino bianco e frutta come prugne e mele, tra gli altri che si trovano naturalmente..
Sinteticamente, il salicilato di metile viene utilizzato nella produzione di agenti aromatizzanti, nonché in alcuni alimenti e bevande..
Indice articolo
- 1 Struttura chimica
- 2 Proprietà
- 3 usi
- 4 Sintesi
- 5 Riferimenti
Struttura chimica
La struttura chimica del salicilato di metile è costituita da due gruppi funzionali principali (un estere e un fenolo ad esso collegati), come mostrato nell'immagine sopra.
Si osserva che è costituito da un anello benzenico (che rappresenta un'influenza diretta sulla reattività e stabilità del composto), proveniente dall'acido salicilico da cui è derivato..
Per nominarli separatamente, si può dire che un gruppo idrossile e un estere metilico sono attaccati in posizione orto (1,2) al suddetto anello..
Quindi, poiché il gruppo OH è attaccato all'anello benzenico, si forma un fenolo, ma il gruppo che ha la “gerarchia” più alta in questa molecola è l'estere, conferendo a questo composto una struttura particolare e, quindi, caratteristiche abbastanza specifiche..
In questo modo, il suo nome chimico viene presentato come 2-idrossibenzoato di metile, concesso dalla IUPAC sebbene sia usato meno frequentemente quando si fa riferimento a questo composto..
Proprietà
- È una specie chimica che appartiene al gruppo dei salicilati, che sono prodotti di origine naturale dal metabolismo di alcuni organismi vegetali..
- Sono note le proprietà terapeutiche dei salicilati nei trattamenti medici.
- Questo composto è presente in alcune bevande come il vino bianco, il tè, la salvia e alcuni frutti come la papaia o la ciliegia..
- Si trova naturalmente nelle foglie di un gran numero di piante, soprattutto in alcune famiglie.
- Appartiene al gruppo degli esteri organici sintetizzabili in laboratorio.
- Si ottiene allo stato liquido, la cui densità è di circa 1.174 g / ml in condizioni standard di pressione e temperatura (1 atm e 25 ° C)..
- Forma una fase liquida incolore, giallastra o rossastra, considerata solubile in acqua (che è un solvente inorganico) e in altri solventi organici.
- Il suo punto di ebollizione è di circa 222 ° C, manifestando la sua decomposizione termica intorno a 340-350 ° C.
- Ha molteplici applicazioni, che vanno dall'agente aromatizzante nell'industria delle caramelle all'antidolorifico e altri prodotti nell'industria farmaceutica.
- La sua formula molecolare è rappresentata come C8H8O3 e ha una massa molare di 152,15 g / mol.
Applicazioni
Per le sue caratteristiche strutturali, essendo un estere metilico dell'acido salicilico, il salicilato di metile ha un gran numero di usi in diverse aree.
Uno degli usi principali (e il più noto) di questa sostanza è come agente aromatizzante in diversi prodotti: dall'industria cosmetica come profumo all'industria alimentare come aroma nei dolci (gomme da masticare, caramelle, gelati, tra gli altri ).
Viene anche utilizzato nell'industria cosmetica come agente riscaldante e per il massaggio muscolare nelle applicazioni sportive. In quest'ultimo caso agisce come un rubefacente; cioè provoca arrossamenti superficiali della pelle e delle mucose a contatto con queste.
Allo stesso modo, viene utilizzato in una crema per uso topico, per le sue proprietà analgesiche e antinfiammatorie nei trattamenti per le condizioni reumatiche..
Un'altra delle sue applicazioni include il suo uso liquido nelle sedute di aromaterapia, grazie alle sue caratteristiche di olio essenziale..
Oltre al suo utilizzo come agente di protezione contro le radiazioni ultraviolette nei filtri solari, le sue proprietà contro la luce sono studiate per applicazioni tecnologiche, come la produzione di raggi laser o la creazione di specie sensibili alla memorizzazione di informazioni all'interno di molecole..
Sintesi
Innanzitutto va ricordato che il salicilato di metile può essere ottenuto naturalmente dalla distillazione dei rami di alcune piante, come il wintergreen (Gaultheria procumbens) o betulla dolce (Betula lenta).
Questa sostanza fu estratta e isolata per la prima volta nel 1843 grazie allo scienziato di origine francese chiamato Auguste Cahours; da wintergreen, è attualmente ottenuto per sintesi in laboratorio e anche commercialmente.
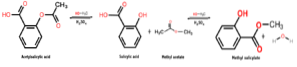
La reazione che si verifica per ottenere questo composto chimico è un processo chiamato esterificazione, in cui si ottiene un estere attraverso la reazione tra un alcol e un acido carbossilico. In questo caso, si verifica tra metanolo e acido salicilico, come mostrato di seguito:
CH3OH + C7H6O3 → C8H8O3 + HDueO
Va notato che la parte della molecola di acido salicilico che viene esterificata con il gruppo idrossile (OH) dell'alcool è il gruppo carbossilico (COOH).
Quindi, ciò che accade tra queste due specie chimiche è una reazione di condensazione, perché la molecola d'acqua presente tra i reagenti viene rimossa mentre le altre specie reagenti vengono condensate per ottenere il salicilato di metile..
L'immagine seguente mostra la sintesi del salicilato di metile dall'acido salicilico, dove vengono mostrate due reazioni successive.
Riferimenti
- Wikipedia. (s.f.). Salicilato di metile. Estratto da en.wikipedia.org
- Britannica, E. (s.f.). Salicilato di metile. Estratto da britannica.com
- Consiglio d'Europa. Comitato di esperti sui prodotti cosmetici. (2008). Ingredienti attivi utilizzati nei cosmetici: indagine sulla sicurezza. Recupero da books.google.co.ve
- Dasgupta, A. e Wahed, A. (2013). Chimica clinica, immunologia e controllo di qualità di laboratorio. Ottenuto da books.google.co.ve
- PubChem. (s.f.) Salicilato di metile. Recupero da pubchem.ncbi.nlm.nih.gov



Nessun utente ha ancora commentato questo articolo.