
Regola di Hund o principio della massima molteplicità
Il Regola di Hund o principio della massima molteplicità stabilisce, empiricamente, come devono occupare gli elettroni orbitali degenerati dall'energia. Questa regola, come suggerisce solo il nome, venne dal fisico tedesco Friedrich Hund, nel 1927, e da allora è stata molto utile nella chimica quantistica e spettroscopica..
Ci sono davvero tre regole di Hund applicate alla chimica quantistica; Tuttavia, il primo è il più semplice per la comprensione di base di come strutturare elettronicamente un atomo.
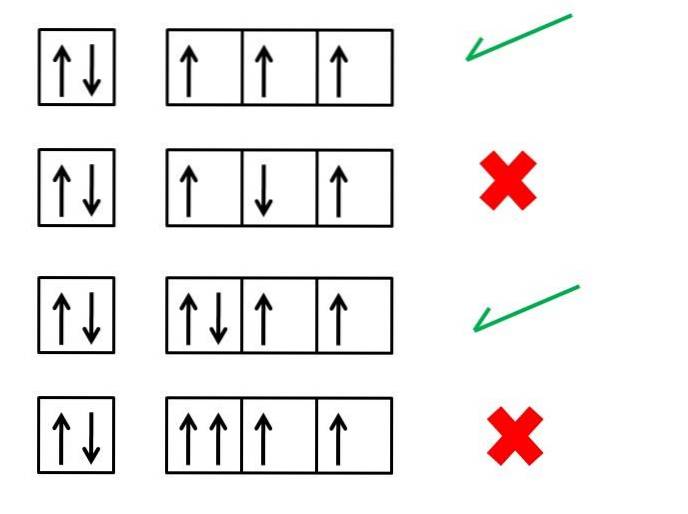
La prima regola di Hund, quella della massima molteplicità, è essenziale per comprendere le configurazioni elettroniche degli elementi; stabilisce quale dovrebbe essere l'ordine degli elettroni negli orbitali per generare un atomo (ione o molecola) con maggiore stabilità.
Ad esempio, l'immagine sopra mostra quattro serie di configurazioni elettroniche; le caselle rappresentano gli orbitali e le frecce nere rappresentano gli elettroni.
La prima e la terza serie corrispondono a modi corretti per ordinare gli elettroni, mentre la seconda e la quarta serie indicano come gli elettroni non dovrebbero essere posizionati negli orbitali.
Indice articolo
- 1 Ordine di riempimento degli orbitali secondo la regola di Hund
- 1.1 Accoppiamento di giri
- 1.2 Spin paralleli e antiparalleli
- 2 Molteplicità
- 3 esercizi
- 3.1 Fluoro
- 3.2 Titanio
- 3.3 Ferro
- 4 Riferimenti
Ordine di riempimento orbitale secondo la regola di Hund
Sebbene non si faccia menzione delle altre due regole di Hund, eseguire correttamente l'ordine di riempimento implica implicitamente l'applicazione di queste tre regole contemporaneamente.
Cosa hanno in comune la prima e la terza serie di orbitali nell'immagine? Perché sono corretti? Per cominciare, ogni orbitale può "ospitare" solo due elettroni, motivo per cui la prima scatola è completa. Il riempimento deve quindi proseguire con le tre caselle o orbitali a destra.
Spin accoppiamento
Ogni casella della prima serie ha una freccia che punta verso l'alto, che simboleggia tre elettroni con rotazioni nella stessa direzione. Quando punta verso l'alto, significa che i loro giri hanno un valore di +1/2, e se puntano verso il basso, i loro giri avranno valori di -1/2.
Si noti che i tre elettroni occupano orbitali diversi, ma con giri spaiati.
Nella terza serie, il sesto elettrone si trova con uno spin nella direzione opposta, -1/2. Questo non è il caso della quarta serie, dove questo elettrone entra nell'orbitale con uno spin di +1/2.
E così, i due elettroni, come quelli del primo orbitale, avranno il loro giri accoppiati (uno con spin +1/2 e uno con spin -1/2).
La quarta serie di scatole o orbitali viola il principio di esclusione di Pauli, che afferma che nessun elettrone può avere gli stessi quattro numeri quantici. La regola di Hund e il principio di esclusione di Pauli vanno sempre di pari passo.
Pertanto, le frecce devono essere posizionate in modo tale da non essere accoppiate fino a quando non occupano tutte le caselle; e subito dopo si completano con le frecce che puntano nella direzione opposta.
Spin paralleli e antiparalleli
Non è sufficiente che gli elettroni abbiano i loro spin accoppiati: devono anche essere paralleli. Ciò nella rappresentazione di caselle e frecce è garantito ponendo queste ultime con le estremità parallele tra loro..
La seconda serie presenta l'errore che l'elettrone nella terza scatola incontra il suo spin in senso antiparallelo rispetto agli altri..
Quindi, si può riassumere che lo stato fondamentale di un atomo è quello che obbedisce alle regole di Hund, e quindi ha la struttura elettronica più stabile.
La base teorica e sperimentale afferma che quando un atomo ha elettroni con un maggior numero di spin spaiati e paralleli, si stabilizza per effetto di un aumento delle interazioni elettrostatiche tra il nucleo e gli elettroni; aumento dovuto alla diminuzione dell'effetto schermante.
Molteplicità
La parola "molteplicità" è stata menzionata all'inizio, ma cosa significa in questo contesto? La prima regola di Hund stabilisce che lo stato fondamentale più stabile per un atomo è quello con il maggior numero di molteplicità di spin; in altre parole, quello con i suoi orbitali con il maggior numero di elettroni spaiati.
La formula per calcolare la molteplicità dello spin è
2S + 1
Dove S è uguale al numero di elettroni spaiati moltiplicato per 1/2. Quindi, avendo più strutture elettroniche con lo stesso numero di elettroni, 2S + 1 può essere stimato per ciascuna e quella con il valore di molteplicità più alto sarà la più stabile..
La molteplicità di spin può essere calcolata per la prima serie di orbitali con tre elettroni con i loro spin ineguagliabili e paralleli:
S = 3 (1/2) = 3/2
E la molteplicità allora è
2 (3/2) + 1 = 4
Questa è la prima regola di Hund. La configurazione più stabile deve rispettare anche altri parametri, ma che per scopi di comprensione chimica non sono del tutto necessari..
Formazione
Fluoro
Viene considerato solo il guscio di valenza, poiché si presume che il guscio interno sia già pieno di elettroni. La configurazione elettronica del fluoro è quindi [He] 2sDue2 P5.
È necessario riempire prima un orbitale di 2 secondi e poi tre orbitali p. Per riempire l'orbitale 2s con i due elettroni, è sufficiente posizionarli in modo tale che i loro giri siano accoppiati.
Gli altri cinque elettroni per i tre orbitali 2p sono disposti come illustrato di seguito.
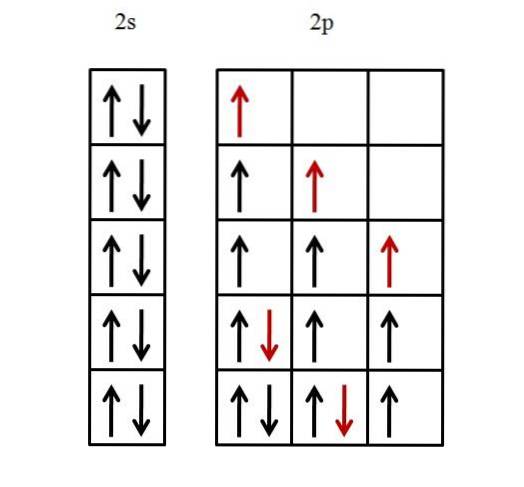
La freccia rossa rappresenta l'ultimo elettrone a riempire gli orbitali. Si noti che i primi tre elettroni che entrano negli orbitali 2p sono posizionati spaiati e con i loro giri paralleli.
Quindi, dal quarto elettrone, inizia ad accoppiare il suo spin -1/2 con l'altro elettrone. Il quinto e ultimo elettrone procede allo stesso modo.
Titanio
La configurazione elettronica del titanio è [Ar] 3dDue4sDue. Poiché ci sono cinque orbitali d, si consiglia di iniziare dal lato sinistro:
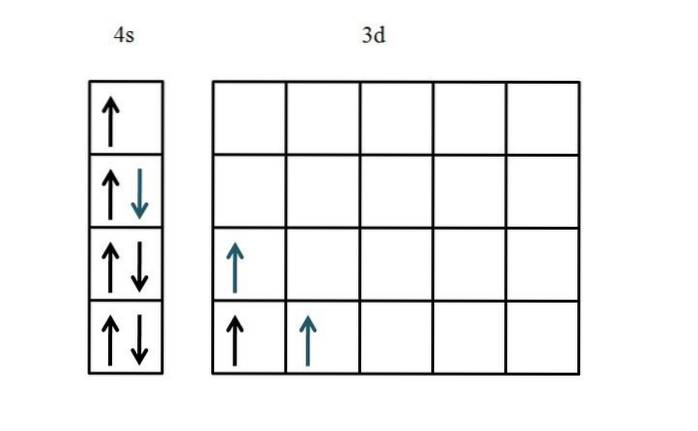
Questa volta è stato mostrato il riempimento dell'orbitale 4s. Poiché ci sono solo due elettroni negli orbitali 3d, non c'è quasi nessun problema o confusione quando li si posiziona con i loro spin non accoppiati e paralleli (frecce blu).
Ferro
Un altro esempio, e infine, è il ferro, un metallo che ha più elettroni nei suoi orbitali d rispetto al titanio. La sua configurazione elettronica è [Ar] 3d64sDue.
Se non fosse per la regola di Hund e per il principio di esclusione di Pauli, non sapremmo come disporre questi sei elettroni nei loro cinque orbitali d..
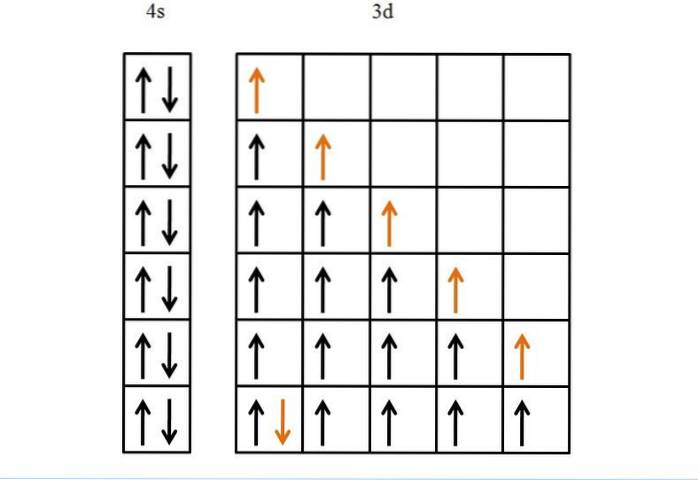
Sebbene possa sembrare facile, senza queste regole potrebbero sorgere molte possibilità sbagliate riguardo all'ordine di riempimento degli orbitali.
Grazie a questi l'avanzamento della freccia d'oro è logico e monotono, che altro non è che l'ultimo elettrone ad essere collocato negli orbitali..
Riferimenti
- Serway e Jewett. (2009). Fisica: per la scienza e l'ingegneria con la fisica moderna. Volume 2. (Settima edizione). Cengage Learning.
- Glasstone. (1970). Libro di testo di chimica fisica. Nel Cinetica chimica. Seconda edizione. D. Van Nostrand, Company, Inc.
- Méndez A. (21 marzo 2012). La regola di Hund. Estratto da: quimica.laguia2000.com
- Wikipedia. (2018). La regola di Hund della massima molteplicità. Estratto da: en.wikipedia.org
- Chemistry LibreTexts. (23 agosto 2017). Regole di Hund. Recupero da: chem.libretexts.org
- Nave R. (2016). Regole di Hund. Estratto da: hyperphysics.phy-astr.gsu.edu

Nessun utente ha ancora commentato questo articolo.