
Reazioni ed esempi di spostamento singolo, doppio
Il reazioni di spostamento sono tutti quelli in cui una specie chimica ne sposta un'altra all'interno di un composto. Questo spostamento può essere semplice o doppio, differendo per il fatto che nel primo è un elemento che viene spostato, mentre nel secondo si ha un cambio di "coppie" tra due composti..
Questi tipi di reazioni sono possibili solo in determinate condizioni: una delle specie deve avere un numero di ossidazione pari a zero o tutte devono essere necessariamente ionizzate. Cosa significa un numero di ossidazione pari a zero? Significa che la specie è nel suo stato naturale.

Un esempio molto illustrativo dell'approccio di cui sopra è la reazione tra un filo di rame e una soluzione di nitrato d'argento. Poiché il rame è un metallo nel suo stato naturale, il suo numero di ossidazione è zero; d'altra parte, quello dell'argento è +1 (Ag+), che si trova disciolto insieme agli ioni nitrato (NO3-).
I metalli cedono gli elettroni, ma alcuni sono più attivi di altri; Ciò significa che non tutti i metalli si arrugginiscono così facilmente. Poiché il rame è più attivo dell'argento, dona i suoi elettroni, riducendolo al suo stato naturale, riflesso come una superficie d'argento che copre il filo di rame (immagine sopra).
Indice articolo
- 1 Reazioni di spostamento
- 1.1 Semplice
- 1.2 Doppio
- 2 esempi
- 2.1 Semplice
- 2.2 Doppio
- 3 Riferimenti
Reazioni di spostamento
Semplice
Spostamento di idrogeno e metalli
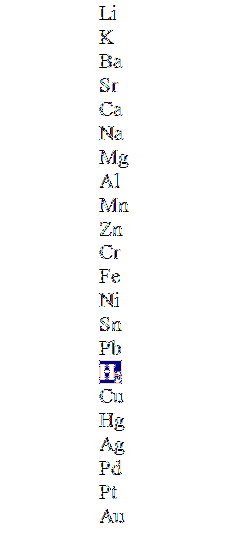
L'immagine in alto mostra una colonna in ordine decrescente di attività, evidenziando la molecola di idrogeno. Quei metalli che sono al di sopra di questo possono spostarlo negli acidi non ossidanti (HCl, HF, HDueSW4, ecc.) e quelli di seguito non reagiranno affatto.
La semplice reazione di spostamento può essere descritta dalla seguente equazione generale:
A + BC => AB + C
A sposta C, che potrebbe essere la molecola H.Due o altro metallo. siDue è formato dalla riduzione degli ioni H.+ (2H+ + 2e- => HDue), quindi specie A deve - per la conservazione di massa ed energia - fornire gli elettroni: deve essere ossidato.
D'altra parte, se A e C sono specie metalliche, ma C è nella forma ionica (M+) e A nel suo stato naturale, allora la reazione di spostamento avverrà solo se A è più attivo di C, costringendo quest'ultimo ad accettare elettroni per ridursi al suo stato metallico (M).
Cilindrata con alogeni
Allo stesso modo, gli alogeni (F, Cl, Br, I, At) possono muoversi tra loro ma seguendo un'altra serie di attività. Per questi, l'attività diminuisce man mano che si scende attraverso il gruppo 7A (o 17): I. Ad esempio, la seguente reazione si verifica naturalmente: FDue(g) + 2NaI (ac) => 2NaF (ac) + IDue(S) Quest'altro però non produce alcun prodotto per i motivi appena spiegati: ioDue(s) + NaF (ac) => X Nell'equazione precedente X significa che non c'è reazione. Con questa conoscenza è possibile prevedere quale miscela di sali alogeni con gli elementi puri produce i prodotti. Come regola pratica, lo iodio (un solido viola volatile) non sposta nessuno degli altri alogeni, ma gli altri lo spostano quando in forma ionica (Na+ io-). La reazione di doppio spostamento, nota anche come reazione di metatesi, è rappresentata come segue: AB + CD => AD + CB Questa volta, non solo A sposta C, ma anche B sposta D. Questo tipo di spostamento si verifica solo quando si mescolano soluzioni di sali solubili e si forma un precipitato; cioè AD o CB devono essere insolubili e avere forti interazioni elettrostatiche. Ad esempio, quando si mescolano soluzioni KBr e AgNO3, i quattro ioni si muovono attraverso il mezzo fino a formare le coppie corrispondenti dell'equazione: KBr (ac) + AgNO3(ac) => AgBr (s) + KNO3(AC) Ioni Ag+ e fr- formano il precipitato di bromuro d'argento, mentre K+ e no3- non può essere organizzato per formare un cristallo di nitrato di potassio. Quando un acido viene neutralizzato con una base, si verifica una doppia reazione di spostamento: HCl (aq) + NaOH (aq) => NaCl (aq) + HDueO (l) Qui non si forma precipitato, poiché il cloruro di sodio è un sale molto solubile in acqua, ma si verifica un cambiamento di pH, che si regola ad un valore vicino a 7. Tuttavia, nella seguente reazione, si verificano contemporaneamente una variazione del pH e la formazione di un precipitato: H3PO4(ac) + 3Ca (OH)Due => Ca3(PO4)Due(s) + 3HDueO (l) Il fosfato di calcio è insolubile, precipitando come un solido bianco, mentre l'acido fosforico viene neutralizzato con idrossido di calcio. Cu (s) + 2AgNO3(ac) => Cu (NO3)Due(ac) + 2Ag (s) Questa è la reazione dell'immagine del filo di rame. Se guardi la serie di attività chimiche per i metalli, scoprirai che il rame è al di sopra dell'argento, quindi può sostituirlo. Zn (s) + CuSO4(ac) => ZnSO4(ac) + Cu (s) Con quest'altra reazione, avviene il contrario: ora la soluzione bluastra di CuSO4 diventa trasparente come il rame precipita come metallo e allo stesso tempo lo zinco metallico si disintegra in sale solfato di solfato di zinco. 2Al (s) + 3NiBrDue(ac) => 2AlBr3(ac) + 3Ni (s) Ancora una volta, questa reazione si verifica perché l'alluminio è al di sopra del nichel nella serie di attività chimiche. Sn (s) + HDueSW4(ac) => SnSO4(ac) + HDue(g) Qui lo stagno sposta l'idrogeno, sebbene sia molto vicino ad esso nella serie. 2K (s) + 2HDueO (l) => 2KOH (aq) + HDue(g) Infine, quei metalli che sono nella parte più alta della serie sono così reattivi da spostare anche l'idrogeno nelle molecole d'acqua, generando una reazione molto esotermica (ed esplosiva).. Zn (NO3)Due(aq) + 2NaOH (aq) => Zn (OH)Due(s) + 2NaNO3(AC) Sebbene la base non neutralizzi gli acidi, gli ioni OH- sentire più affinità per ZnDue+ che gli ioni NON lo sono3-; per questo motivo si verifica il doppio spostamento. Francobollo3)Due(ac) + NaDueS (ac) => CuS (s) + 2NaNO3(AC) Questa reazione è molto simile alla precedente, con la differenza che entrambi i composti sono sali disciolti in acqua..Doppio
Reazione di neutralizzazione acido-base
Esempi
Semplice
Doppio
Riferimenti



Nessun utente ha ancora commentato questo articolo.