
Raggio atomico come viene misurato, come cambia ed esempi
Il radio atomica è un parametro importante per le proprietà periodiche degli elementi della tavola periodica. È direttamente correlato alla dimensione degli atomi, poiché maggiore è il raggio, più grandi o voluminosi sono. Allo stesso modo, è correlato alle loro caratteristiche elettroniche..
Più elettroni ha un atomo, maggiori sono le sue dimensioni atomiche e il suo raggio. Entrambi sono definiti dagli elettroni del guscio di valenza, perché a distanze oltre le loro orbite, la probabilità di trovare un elettrone si avvicina allo zero. In prossimità del nucleo avviene l'opposto: la probabilità di trovare un elettrone aumenta.

L'immagine in alto rappresenta una confezione di batuffoli di cotone. Nota che ognuno è circondato da sei vicini, senza contare un'altra possibile riga superiore o inferiore. Il modo in cui i batuffoli di cotone vengono compattati definirà le loro dimensioni e, quindi, i loro raggi; proprio come gli atomi.
Gli elementi in base alla loro natura chimica interagiscono con i propri atomi in un modo o nell'altro. Di conseguenza, l'ampiezza del raggio atomico varia a seconda del tipo di legame presente e dell'impaccamento solido dei suoi atomi..
Indice articolo
- 1 Come viene misurato il raggio atomico?
- 1.1 Determinazione della distanza internucleare
- 1.2 Unità
- 2 Come cambia nella tavola periodica?
- 2.1 In un periodo
- 2.2 Discesa attraverso un gruppo
- 2.3 Contrazione dei lantanidi
- 3 esempi
- 4 Riferimenti
Come si misura il raggio atomico?
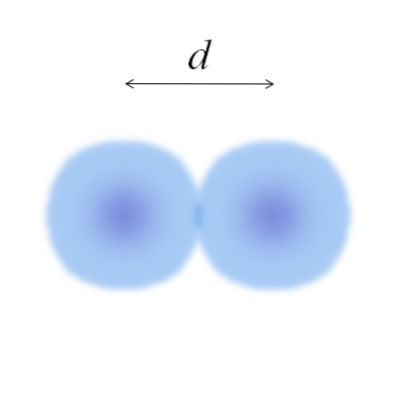
Nell'immagine principale può essere facile misurare il diametro dei batuffoli di cotone e poi dividerlo per due. Tuttavia, la sfera di un atomo non è completamente definita. Perché? Perché gli elettroni circolano e si diffondono in specifiche regioni dello spazio: gli orbitali.
Pertanto, l'atomo può essere considerato come una sfera dai bordi impalpabili, di cui è impossibile dire con certezza fino a che punto finiscono. Ad esempio, nell'immagine sopra, la regione del centro, vicino al nucleo, mostra un colore più intenso, mentre i suoi bordi sono sfocati..
L'immagine rappresenta una molecola biatomica EDue (come il ClDue, HDue, ODue, eccetera.). Supponendo che gli atomi siano corpi sferici, se la distanza fosse determinata d che separa entrambi i nuclei nel legame covalente, sarebbe quindi sufficiente dividerlo in due metà (d/ 2) per ottenere il raggio atomico; più precisamente, il raggio covalente da E a EDue.
E se E non avesse formato legami covalenti con se stesso, ma fosse un elemento metallico? Poi d sarebbe indicato dal numero di vicini che circondano E nella sua struttura metallica; ovvero dal numero di coordinazione (N.C) dell'atomo all'interno della confezione (ricorda i batuffoli di cotone nell'immagine principale).
Determinazione della distanza internucleare
Determinare d, che è la distanza internucleare per due atomi in una molecola o in una confezione, sono necessarie tecniche di analisi fisica.
Uno dei più utilizzati è la diffrazione dei raggi X. In essa, un raggio di luce viene irradiato attraverso un cristallo e viene studiato il modello di diffrazione risultante dalle interazioni tra gli elettroni e la radiazione elettromagnetica. A seconda dell'imballaggio, è possibile ottenere diversi modelli di diffrazione e, quindi, altri valori di d.
Se gli atomi sono "stretti" nel reticolo cristallino, presenteranno valori diversi di d rispetto a quello che avrebbero se fossero "comodi". Allo stesso modo, queste distanze internucleari potrebbero variare di valori, quindi il raggio atomico consiste in realtà in un valore medio di tali misurazioni..
Come sono correlati il raggio atomico e il numero di coordinazione? V. Goldschmidt ha stabilito una relazione tra i due, in cui per un N.C di 12, il valore relativo è 1; 0.97 per un imballaggio dove l'atomo ha N.C uguale a 8; 0.96, per un N.C uguale a 6; e 0,88 per un N.C di 4.
Unità
Dai valori di N.C pari a 12 sono state costruite molte delle tabelle dove si confrontano i raggi atomici di tutti gli elementi della tavola periodica.
Poiché non tutti gli elementi formano tali strutture compatte (N.C inferiore a 12), la relazione V. Goldschmidt viene utilizzata per calcolare i loro raggi atomici ed esprimerli per lo stesso impacchettamento. In questo modo vengono standardizzate le misure dei raggi atomici..
Ma in quali unità si esprimono? dato che d è di grandezza molto piccola, dobbiamo ricorrere alle unità angstrom Å (10 ∙ 10-10m) o anche molto diffuso, il picometro (10 ∙ 10-12m).
Come cambia nella tavola periodica?
Su un periodo
I raggi atomici determinati per gli elementi metallici sono chiamati raggi metallici, mentre per gli elementi non metallici, i raggi covalenti (come il fosforo, P4, o zolfo, S8). Tuttavia, tra i due tipi di raggi c'è una distinzione più evidente di quella del nome.
Da sinistra a destra nello stesso periodo, il nucleo aggiunge protoni ed elettroni, ma questi ultimi sono confinati allo stesso livello di energia (numero quantico principale). Di conseguenza, il nucleo esercita una carica nucleare efficace crescente sugli elettroni di valenza, che contrae il raggio atomico..
In questo modo, gli elementi non metallici nello stesso periodo tendono ad avere raggi atomici (covalenti) più piccoli rispetto ai metalli (raggi metallici).
Scendendo attraverso un gruppo
Mentre scendi attraverso un gruppo, vengono abilitati nuovi livelli di energia, che consentono agli elettroni di avere più spazio. Pertanto, la nuvola elettronica copre distanze maggiori, la sua periferia sfocata finisce per allontanarsi ulteriormente dal nucleo e, quindi, il raggio atomico si espande..
Contrazione dei lantanidi
Gli elettroni nel guscio interno aiutano a schermare la carica nucleare effettiva sugli elettroni di valenza. Quando gli orbitali che compongono gli strati interni hanno molti “buchi” (nodi), come accade con gli orbitali f, il nucleo contrae fortemente il raggio atomico a causa del loro scarso effetto schermante..
Questo fatto è evidenziato nella contrazione dei lantanidi nel periodo 6 della tavola periodica. Da La ad Hf si ha una notevole contrazione del raggio atomico per effetto degli orbitali f, che si “riempiono” man mano che si attraversa il blocco f: quello dei lantanoidi e degli attinoidi.
Un effetto simile può essere osservato anche con gli elementi del blocco p del periodo 4. Questa volta, prodotto del debole effetto schermante degli orbitali d che si riempiono quando attraversano i periodi del metallo di transizione.
Esempi
Per il periodo 2 della tavola periodica i raggi atomici dei suoi elementi sono:
-Li: 257 pm
-Be: 112 pm
-B: 88 pm
-C: 77 pm
-N: 74 pm
-Oppure: 66 pm
-F: 64 ore
Si noti che il litio metallico ha il raggio atomico più grande (257 pm), mentre il fluoro, situato all'estrema destra del periodo, è il più piccolo di tutti (64 pm). Il raggio atomico discende da sinistra a destra nello stesso periodo e i valori elencati lo mostrano.
Il litio, quando forma legami metallici, il suo raggio è metallico; e fluoro, poiché forma legami covalenti (F-F), il suo raggio è covalente.
E se volessi esprimere i raggi atomici in unità di angstrom? Dividili semplicemente per 100: (257/100) = 2,57Å. E così via con il resto dei valori.
Riferimenti
- Chimica 301. Raggi atomici. Recupero da: ch301.cm.utexas.edu
- Fondazione CK-12. (28 giugno 2016). Raggio atomico. Recupero da: chem.libretexts.org
- Tendenze nei raggi atomici. Tratto da: intro.chem.okstate.edu
- Clackamas Community College. (2002). Dimensione atomica. Recupero da: dl.clackamas.edu
- Clark J. (agosto 2012). Raggio atomico e ionico. Estratto da: chemguide.co.uk
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione, pagg. 23, 24, 80, 169). Mc Graw Hill.



Nessun utente ha ancora commentato questo articolo.