
Cosa sono gli orbitali degeneri?
Il orbitali degeneri sono tutti quelli che sono allo stesso livello di energia. Secondo questa definizione, devono avere lo stesso numero quantico principale n. Pertanto, gli orbitali 2s e 2p sono degeneri, poiché appartengono al livello di energia 2. Tuttavia, è noto che le loro funzioni d'onda angolare e radiale sono diverse.
Come i valori di n, gli elettroni iniziano ad occupare altri sottolivelli di energia, come gli orbitali de f. Ciascuno di questi orbitali ha le proprie caratteristiche, che a prima vista si possono vedere nelle loro forme angolari; Queste sono le figure sferiche, manubri (p), quadrifoglio (d) e globulari (f).
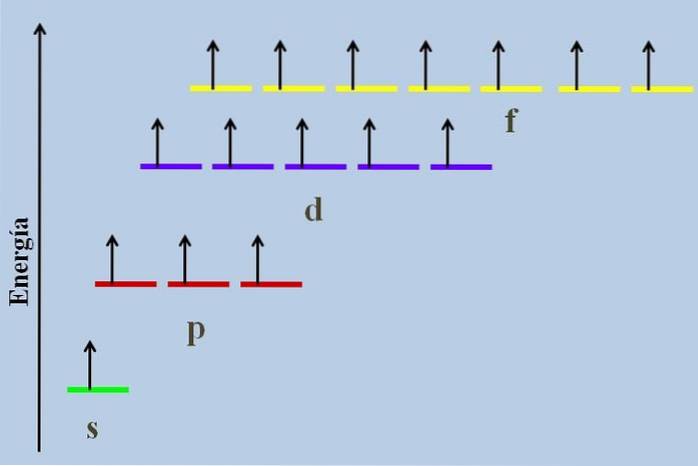
Tra di loro c'è una differenza energetica, anche se appartengono allo stesso livello n.
Ad esempio, l'immagine sopra mostra uno schema energetico con gli orbitali occupati da elettroni spaiati (un caso anormale). Si può vedere che tra tutti il più stabile (quello con l'energia più bassa) è l'orbitale ns (1s, 2s, ...), mentre l'nf è il più instabile (quello con l'energia più alta).
Indice articolo
- 1 Orbitali degeneri di un atomo isolato
- 1.1 Orbitali p
- 1.2 Orbitali d
- 1.3 Orbitali f
- 2 orbitali ibridi degeneri
- 3 Riferimenti
Orbitali degeneri di un atomo isolato
Orbitali degeneri, con lo stesso valore di n, sono sulla stessa linea in uno schema energetico. Per questo motivo le tre strisce rosse che simboleggiano gli orbitali p si trovano sulla stessa linea; come fanno le strisce viola e gialle allo stesso modo.
Il diagramma nell'immagine viola la regola di Hund: gli orbitali ad alta energia sono pieni di elettroni senza accoppiarli prima in quelli a bassa energia. Quando gli elettroni si accoppiano, l'orbitale perde energia ed esercita una maggiore repulsione elettrostatica sugli elettroni spaiati degli altri orbitali..
Tuttavia, tali effetti non sono considerati in molti diagrammi energetici. Se è così, e obbedendo alla regola di Hund senza riempire completamente gli orbitali d, si vedrebbe che smettono di essere degenerati.
Come accennato in precedenza, ogni orbitale ha le sue caratteristiche. Un atomo isolato, con la sua configurazione elettronica, ha i suoi elettroni disposti nel numero preciso di orbitali per accoglierli. Solo quelli uguali in energia possono essere considerati degenerati.
Orbitali p
Le tre strisce rosse per gli orbitali p degeneri nell'immagine indicano che entrambi i pX, pY E pz possiedono la stessa energia. C'è un elettrone spaiato in ciascuno, descritto da quattro numeri quantici (n, l, ml Y SM), mentre i primi tre descrivono gli orbitali.
L'unica differenza tra loro è denotata dal momento magnetico ml, che disegna il percorso di pX su un asse x, pY sull'asse ye pz sull'asse z. Tutti e tre sono uguali, ma differiscono solo per i loro orientamenti spaziali. Per questo motivo sono sempre disegnati allineati in energia, cioè degenerati.
Poiché sono uguali, un atomo di azoto isolato (con configurazione 1sDue2sDue2 P3) deve mantenere i suoi tre orbitali p degenerati. Tuttavia, lo scenario energetico cambia bruscamente se si considera un atomo di azoto all'interno di una molecola o di un composto chimico..
Perché? Perché sebbene pX, pY E pz sono uguali in energia, questa può variare in ognuna di esse se hanno ambienti chimici differenti; cioè, se si legano ad atomi differenti.
Orbitali d
Ci sono cinque strisce viola che denotano gli orbitali d. In un atomo isolato, anche se hanno elettroni accoppiati, questi cinque orbitali sono considerati degeneri. Tuttavia, a differenza degli orbitali p, questa volta c'è una marcata differenza nelle loro forme angolari.
Pertanto, i suoi elettroni viaggiano in direzioni nello spazio che variano da un orbitale d all'altro. Ciò causa, secondo teoria del campo cristallino, che un disturbo minimo provoca a scissione dell'energia degli orbitali; cioè, le cinque strisce viola si separano, lasciando un divario di energia tra di loro:
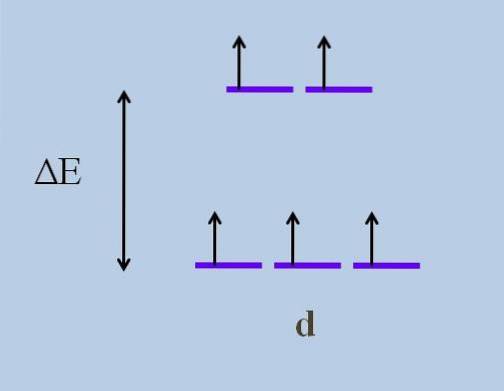
Quali sono gli orbitali superiori e quali sono gli orbitali inferiori? Quelli sopra sono simbolizzati come eg, e quelli di seguito t2 g. Nota come inizialmente tutte le strisce viola erano allineate e ora si è formato un insieme di due orbitali eg più energico dell'altro set di tre orbitali t2 g.
Questa teoria ci permette di spiegare le transizioni d-d, a cui vengono attribuiti molti dei colori osservati nei composti dei metalli di transizione (Cr, Mn, Fe, ecc.). E qual è la causa di questo disturbo elettronico? Alle interazioni di coordinamento del centro metallico con altre molecole chiamate ligandi.
Orbitali f
E con gli orbitali f, le strisce gialle in feltro, la situazione diventa ancora più complicata. Le loro direzioni spaziali variano molto tra loro e la visualizzazione dei loro collegamenti diventa troppo complessa.
In effetti, gli orbitali f sono considerati così rivestiti internamente da non "partecipare in modo apprezzabile" alla formazione del legame..
Quando l'atomo isolato con orbitali f si circonda di altri atomi, iniziano le interazioni e si verifica il dispiegamento (la perdita della degenerazione):
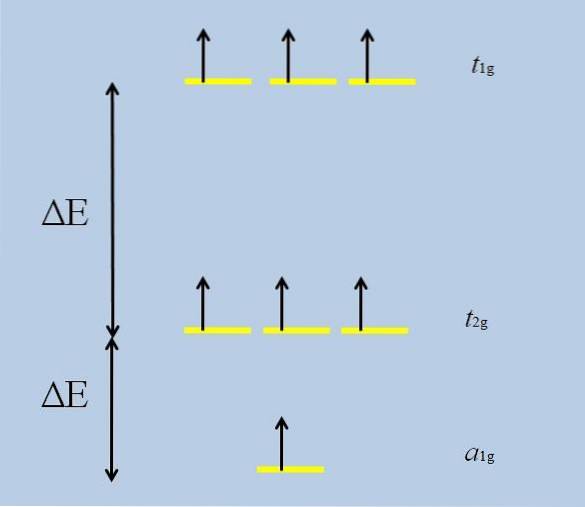
Nota che ora le strisce gialle formano tre serie: t1g, t2 g Y per1g, e che non sono più degenerati.
Orbitali ibridi degeneri
È stato visto che gli orbitali possono dispiegarsi e perdere la degenerazione. Tuttavia, mentre questo spiega le transizioni elettroniche, impallidisce nel chiarire come e perché ci sono diverse geometrie molecolari. È qui che entrano in gioco gli orbitali ibridi..
Quali sono le sue caratteristiche principali? Che sono degenerati. Quindi, derivano dalla miscela di caratteri degli orbitali s, p, d e f, per originare ibridi degenerati.
Ad esempio, tre orbitali p si mescolano con uno s per dare quattro orbitali sp3. Tutti gli orbitali sp3 sono degeneri e quindi hanno la stessa energia.
Se inoltre due d orbitali vengono mescolati con i quattro sp3, otterrai sei orbitali sp3dDue.
E come spiegano le geometrie molecolari? Poiché sono sei, con energie uguali, devono quindi essere orientate simmetricamente nello spazio per generare ambienti chimici uguali (ad esempio, in un composto MF6).
Quando lo fanno, si forma un ottaedro di coordinazione, che è uguale a una geometria ottaedrica attorno a un centro (M).
Tuttavia, le geometrie sono spesso distorte, il che significa che anche gli orbitali ibridi non sono realmente completamente degenerati. Pertanto, in conclusione, gli orbitali degeneri esistono solo in atomi isolati o in ambienti altamente simmetrici..
Riferimenti
- Dizionario Chemicool. (2017). Definizione degenerate. Estratto da: chemicool.com
- SparkNotes LLC. (2018). Atomi e orbitali atomici. Estratto da: sparknotes.com
- Chimica pura. (s.f.). Configurazione elettronica. Estratto da: es-puraquimica.weebly.com
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Moreno R. Esparza. (2009). Corso di chimica di coordinamento: Campi e orbitali. [PDF]. Estratto da: depa.fquim.unam.mx
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.



Nessun utente ha ancora commentato questo articolo.