
Cosa sono gli elementi biatomici? (Esempi)
Il elementi biatomici, Chiamate anche molecole biatomiche omonucleari, sono costituite da due soli atomi degli stessi elementi chimici. Alcuni elementi non possono esistere da soli, anche se isolati da qualsiasi altro tipo di atomo.
Elementi di questa natura si combineranno con atomi dello stesso elemento per essere stabili. In altre parole, l'idrogeno, un elemento biatomico, non può essere da solo. Non può semplicemente esistere H.
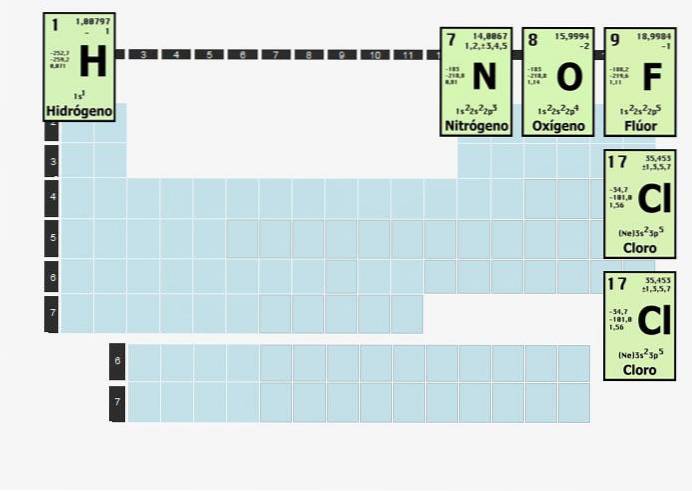
L'idrogeno è così reattivo che quando è isolato da tutto tranne che dall'idrogeno, si combina in una molecola biatomica (a due atomi). Quindi, l'idrogeno gassoso, che a volte è usato come combustibile, esiste come H.Due.
Molecole biatomiche
Le molecole biatomiche contengono due atomi che sono legati chimicamente. Se i due atomi sono identici, come la molecola di ossigeno (ODue), costituisce una molecola biatomica omonucleare, mentre se gli atomi sono diversi, come nella molecola di monossido di carbonio (CO), forma una molecola biatomica eteronucleare.
Le molecole che contengono più di due atomi sono chiamate molecole poliatomiche, ad esempio anidride carbonica (CODue) e acqua (H.DueO). Le molecole polimeriche possono contenere molte migliaia di atomi componenti.
Ci sono sette elementi che compongono le molecole biatomiche. I seguenti gas a 5 elementi si trovano come molecole biatomiche a temperatura e pressione ambiente:
-Idrogeno - HDue
-Azoto - NDue
-Ossigeno - ODue
-Fluoro - FDue
-Cloro - ClDue
Il bromo e lo iodio esistono comunemente in forma liquida, ma anche come gas biatomici a temperature leggermente superiori, per un totale di 7 elementi biatomici..
-Bromo - BrDue
-Iodio - IDue
Gli elementi biatomici sono gli alogeni (fluoro, cloro, bromo, iodio) e gli elementi con una terminazione -genica (idrogeno, ossigeno, azoto). Astatin è un altro alogeno, ma il suo comportamento è sconosciuto..
Proprietà degli elementi biatomici
Tutte le molecole biatomiche sono lineari, che è la più semplice disposizione spaziale degli atomi.
È conveniente e comune rappresentare una molecola biatomica come due masse puntiformi (i due atomi) collegate da una molla priva di massa..
Le energie coinvolte nei movimenti della molecola possono essere suddivise in tre categorie:
- Le energie traslazionali (la molecola che si sposta dal punto A al punto B)
- Energie rotazionali (la molecola che ruota attorno al suo asse)
- Energie vibrazionali (molecole che vibrano in vari modi)
Tutti gli elementi biatomici sono gas a temperatura ambiente ad eccezione del bromo e dello iodio che sono liquidi (lo iodio può essere anche allo stato solido), e tutti ad eccezione dell'ossigeno e dell'azoto sono legati da un unico legame..
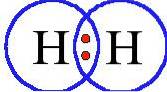
La molecola di ossigeno ha i suoi due atomi uniti da un doppio legame e la molecola di azoto da un triplo legame.
Alcuni elementi biatomici
Idrogeno
Idrogeno (HDue), con un numero atomico di 1, è un gas incolore che non è stato formalmente scoperto come elemento da Henry Cavendish fino al 1766, ma è stato trovato accidentalmente circa cento anni prima da Robert Boyle.
È un gas incolore, inodore e non tossico che esiste naturalmente nel nostro universo. Essendo il primo elemento della tavola periodica, l'idrogeno è il più leggero e il più abbondante di tutti gli elementi chimici dell'universo poiché costituisce il 75% della sua massa..
Azoto
Azoto (NDue) ha un numero atomico di sette e costituisce circa il 78,05% in volume dell'atmosfera terrestre.
È un gas inodore, incolore e per lo più inerte e rimane incolore e inodore allo stato liquido..

Ossigeno
Ossigeno (ODue) ha un numero atomico otto. Questo gas incolore e inodore ha otto protoni nel suo nucleo ed è di colore blu pallido nello stato liquido e solido..
Un quinto dell'atmosfera terrestre è costituito da ossigeno ed è il terzo elemento più abbondante nell'universo per massa..
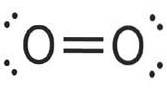
L'ossigeno è l'elemento più abbondante in massa nella biosfera terrestre. L'elevata concentrazione di ossigeno nell'atmosfera è il risultato del ciclo dell'ossigeno terrestre, che è prevalentemente guidato dalla fotosintesi nelle piante..
Fluoro
Fluoro (FDue) ha un numero atomico di nove ed è il più reattivo ed elettronegativo di tutti gli elementi. Questo elemento non metallico è un gas giallo pallido che fa parte del gruppo alogeno.
Sembra che George Gore sia stato il primo scienziato a isolare il fluoro, ma il suo esperimento è esploso quando il fluoro prodotto ha reagito con l'idrogeno..
Nel 1906 Ferdinand Frederic Henri Moissan ricevette il Premio Nobel per la Chimica per il suo lavoro sull'isolamento del fluoro nel 1886. È l'elemento più elettronegativo della tavola periodica..
Cloro
Cloro (clDue) è un membro del gruppo alogeno con un numero atomico diciassette. Una delle sue forme, NaCl, è stata utilizzata fin dai tempi antichi.

Il cloro è stato utilizzato per migliaia di anni in molte altre forme, ma non è stato nominato fino al 1810 da Sir Humphry Davy..
Il cloro nella sua forma pura è verde giallastro, ma i suoi composti comuni sono tipicamente incolori..
Bromo
Bromo (BrDue) ha un numero atomico di trentacinque. È un liquido marrone scuro pesante, l'unico elemento non metallico che è un liquido.

Il bromo fu scoperto da Antoine J. Balard nel 1826. Era usato per scopi importanti molto prima di essere scoperto formalmente..
Iodio
Iodio (IDue) ha un numero atomico di cinquantatre, con cinquantatre protoni nel nucleo di un atomo. È un non metallo blu-nero che svolge un ruolo molto importante nella chimica organica..
Lo iodio fu scoperto nel 1811 da Barnard Courtois. Lo chiamò iodio dalla parola greca "iodes" che significa viola. È un solido blu-nero.
Lo iodio gioca un ruolo molto importante nella biologia di tutti gli organismi viventi poiché la sua carenza porta a malattie come l'ipertiroidismo e l'ipotiroidismo.
Riferimenti
- (S.F.). Molecole biatomiche omonucleari. Recuperato da boundless.com.
- Fatti sul cloro. (S.F.). Recuperato da softschools.com.
- Elementi biatomici. (S.F.). Estratto da ths.talawanda.org.
- Encyclopædia Britannica. (2016, 14 settembre). Molecola. Recuperato da britannica.com.
- Helmenstine, A. (2014, 28 settembre). Elementi biatomici. Estratto da sciencenotes.org.
- Helmenstine, A. M. (2017, 29 marzo). Quali sono i sette elementi biatomici? Recuperato da thoughtco.com.
- Fatti sull'ossigeno. (S.F.). Recuperato da softschools.com.
- Royal Society of Chemistry. (2015). iodio molecolare. Recupero da chemspider.com.


Nessun utente ha ancora commentato questo articolo.