
Qual è lo spettro di emissione? (Con esempi)

Il spettro di emissione è lo spettro delle lunghezze d'onda della luce emessa da atomi e molecole quando si effettua una transizione tra due stati energetici. La luce bianca o visibile che colpisce un prisma si scompone in diversi colori con lunghezze d'onda specifiche per ogni colore. Il modello di colori che si ottiene è lo spettro della radiazione visibile della luce chiamato spettro di emissione.
Atomi, molecole e sostanze hanno anche uno spettro di emissione dovuto all'emissione di luce quando assorbono dall'esterno la giusta quantità di energia per transitare tra due stati energetici. Facendo passare questa luce attraverso un prisma, si scompone in linee colorate spettrali con diverse lunghezze d'onda di ogni elemento..
L'importanza dello spettro di emissione è che permette di determinare la composizione di sostanze sconosciute e oggetti astronomici attraverso l'analisi delle loro linee spettrali utilizzando tecniche di spettroscopia di emissione..
Successivamente, viene spiegato in cosa consiste lo spettro di emissione e come viene interpretato, vengono citati alcuni esempi e le differenze che esistono tra lo spettro di emissione e quello di assorbimento.
Indice articolo
- 1 Cos'è uno spettro di emissione?
- 2 Interpretazione dello spettro di emissione
- 3 Differenza tra spettro di emissione e spettro di assorbimento.
- 4 Esempi di spettri di emissione di elementi chimici
- 5 Riferimenti
Cos'è uno spettro di emissione?
Gli atomi di un elemento o di una sostanza hanno elettroni e protoni che vengono tenuti insieme grazie alla forza di attrazione elettromagnetica. Secondo il modello di Bohr gli elettroni sono disposti in modo tale che l'energia dell'atomo sia la più bassa possibile. Questo livello di energia energetica è chiamato lo stato fondamentale dell'atomo..
Quando gli atomi acquisiscono energia dall'esterno, gli elettroni si muovono verso un livello di energia più elevato e l'atomo cambia il suo stato fondamentale in uno stato eccitato..
Nello stato eccitato, il tempo di permanenza dell'elettrone è molto piccolo (≈ 10-8 s) (1), l'atomo è instabile e ritorna allo stato fondamentale, passando, se necessario, per livelli energetici intermedi.
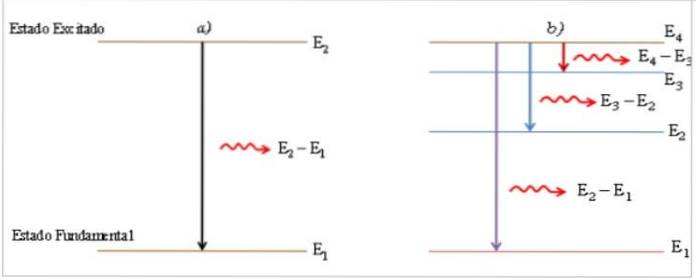
Nel processo di transizione da uno stato eccitato a uno stato fondamentale, l'atomo emette un fotone di luce con energia pari alla differenza di energia tra i due stati, essendo direttamente proporzionale alla frequenza ve inversamente proporzionale alla sua lunghezza d'onda λ.
Il fotone emesso viene mostrato come una linea luminosa, chiamata linea spettrale (2), e la distribuzione di energia spettrale della raccolta di fotoni emessi alle transizioni dell'atomo è lo spettro di emissione.
Interpretazione dello spettro di emissione
Alcune delle transizioni dell'atomo sono causate da un aumento della temperatura o dalla presenza di altre fonti di energia esterne come un fascio di luce, una corrente di elettroni o una reazione chimica..
Se un gas come l'idrogeno viene posto in una camera a bassa pressione e una corrente elettrica viene fatta passare attraverso la camera, il gas emetterà una luce con un proprio colore che lo differenzia dagli altri gas..
Facendo passare la luce emessa, attraverso un prisma, invece di ottenere un arcobaleno di luce, si ottengono unità discrete sotto forma di linee colorate con lunghezze d'onda specifiche, che trasportano discrete quantità di energia.
Le righe dello spettro di emissione sono uniche in ogni elemento e il loro utilizzo dalla tecnica della spettroscopia consente di determinare la composizione elementare di una sostanza sconosciuta nonché la composizione di oggetti astronomici, analizzando le lunghezze d'onda dei fotoni emessi. Durante la transizione dell'atomo..
Differenza tra spettro di emissione e spettro di assorbimento.
Nei processi di assorbimento ed emissione, l'atomo ha transizioni tra due stati energetici, ma è nell'assorbimento che guadagna energia dall'esterno e raggiunge lo stato di eccitazione..
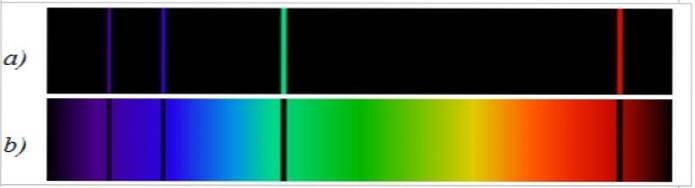
La linea spettrale di emissione è opposta allo spettro continuo della luce bianca. Nel primo si osserva la distribuzione spettrale sotto forma di linee luminose e nel secondo si osserva una banda continua di colori..
Se un fascio di luce bianca colpisce un gas come l'idrogeno, racchiuso in una camera a bassa pressione, solo una parte della luce verrà assorbita dal gas e il resto verrà trasmesso.
Quando la luce trasmessa passa attraverso un prisma si scompone in righe spettrali, ciascuna con una diversa lunghezza d'onda, formando lo spettro di assorbimento del gas..
Lo spettro di assorbimento è totalmente opposto allo spettro di emissione ed è anche specifico per ogni elemento. Confrontando entrambi gli spettri dello stesso elemento, si osserva che le righe spettrali di emissione sono quelle che mancano nello spettro di assorbimento (Figura 2).
Esempi di spettri di emissione di elementi chimici
a) Le righe spettrali dell'atomo di idrogeno, nella regione visibile dello spettro, sono una linea rossa di 656,3 nm, un azzurro di 486,1 nm, un blu scuro di 434 nm e un viola molto debole di 410 nm. Queste lunghezze d'onda sono ottenute dall'equazione di Balmer-Rydberg nella sua versione moderna (3).
è il numero d'onda della riga spettrale
è la costante di Rydberg (109666,56 cm-1)
è il livello di energia più alto
è il livello di energia più alto

b) Lo spettro di emissione dell'elio ha due serie di linee principali, una nella regione del visibile e l'altra vicino all'ultravioletto. Peterson (4) ha utilizzato il modello di Bohr per calcolare una serie di righe di emissione di elio nella porzione visibile dello spettro, come risultato di diverse transizioni simultanee di due elettroni allo stato n = 5, e ha ottenuto valori di lunghezza d'onda coerenti con risultati sperimentali. Le lunghezze d'onda ottenute sono 468,8 nm, 450,1 nm, 426,3 nm, 418,4 nm, 412,2 nm, 371,9 nm.
c) Lo spettro di emissione del sodio ha due linee molto luminose di 589 nm e 589,6 nm chiamate linee D (5). Le altre linee sono molto più deboli di queste e, per scopi pratici, si considera che tutta la luce al sodio provenga dalle linee D..
Riferimenti
- Misura della durata di vita degli stati eccitati dell'atomo di idrogeno. V. A. Ankudinov, S. V. Bobashev ed E. P. Andreev. 1, 1965, Soviet Physics JETP, Vol.21, pagg. 26-32.
- Demtröder, W. Spettroscopia laser 1. Kaiserslautern: Springer, 2014.
- D.K.Rai, S.N Thakur e. Atomo, laser e spettroscopia. Nuova Delhi: Phi Learning, 2010.
- Rivisitazione di Bohr: modello e linee spettrali di elio. Peterson, C. 5, 2016, Journal of young investigators, Vol.30, pp. 32-35.
- Giornale di educazione chimica. J.R. Appling, F. J. Yonke, R. A. Edgington e S. Jacobs. 3, 1993, Vol.70, pagg. 250-251.



Nessun utente ha ancora commentato questo articolo.