
Ragioni, procedure e usi del test dell'ossidasi
Il test ossidasi È un metodo diagnostico che mostra la presenza del complesso enzimatico chiamato citocromo ossidasi c. Questo sistema induce la trasformazione del citocromo ridotto ad ossidato, poiché cattura l'ossigeno e questo a sua volta funge da ultimo accettore di elettroni (H+) nella catena respiratoria.
Il termine ossidasi è un modo abbreviato di riferirsi all'enzima citocromo ossidasi, noto anche come indofenolo ossidasi. Nell'antichità si credeva che gli enzimi citocromo ossidasi e indofenolo ossidasi fossero due enzimi diversi, ma oggi si sa che sono gli stessi.
Da parte loro, i citocromi sono emoproteine che contengono ferro e completano il sistema della citocromo ossidasi. I citocromi possono variare da specie a specie.
Esistono diverse varietà di citocromi (citocromi a1, a2, a3 e 0). Alcuni batteri possono produrne solo uno, ma altri fino a due o tre alla volta. In questo senso, la presenza del citocromo a e a3 è nota come citocromo ossidasi c. Questo è il tipo di citocromo rilevato dal test dell'ossidasi..
I generi Neisseria e Pseudomonas contengono citocromo ossidasi c. Questi generi danno il test positivo dell'ossidasi, aiutando a differenziarli rispettivamente dai generi Acinetobacter e Stenotrophomonas..
Esistono anche altri generi ossidasi positivi.
Indice articolo
- 1 Razionale
- 1.1 Caratteristiche del sistema citocromo ossidasi c
- 1.2 Principio del test
- 2 Procedura
- 2.1 Reagenti
- 2.2 Protocolli
- 3 Usa
- 4 Controllo di qualità
- 5 Limitazioni
- 6 Raccomandazioni
- 7 Riferimenti
Base
Caratteristiche del sistema citocromo ossidasi c
Il sistema della citocromo ossidasi c funziona come segue: i microrganismi ossidasi positivi utilizzano l'ossigeno per generare energia attraverso la respirazione aerobica. Questo sistema funziona grazie al trasporto di elettroni da sostanze donatrici come NADH+ verso le sostanze recettrici, in questo caso l'ossigeno.
Ciò si traduce nella produzione di energia (ATP) e acqua o perossido di idrogeno, a seconda del sistema della citocromo ossidasi che il microrganismo possiede..
Ecco perché la maggior parte dei batteri ossidasi positivi sono anche catalasi positivi, una condizione necessaria per eliminare il perossido di idrogeno prodotto, poiché questa sostanza è tossica per i batteri..
Il sistema citocromo ossidasi c è presente in alcuni batteri aerobi, in alcuni anaerobi facoltativi, in pochi microaerofili e in nessun anaerobi stretti. Quest'ultimo è comprensibile, poiché gli anaerobi stretti non possono vivere in presenza di ossigeno, quindi mancano del sistema della citocromo ossidasi..
Principio di prova
In questo test utilizza sostanze che agiscono come accettori di elettroni artificiali, sostituendo quelle naturali all'interno della catena di trasporto degli elettroni..
Vengono utilizzati principalmente coloranti come la parafenilendiammina e l'indofenolo, che agiscono come substrati recettoriali e donatori di elettroni artificiali.
La parafenilendiammina è ossidata dal sistema della citocromo ossidasi c. Il colorante nella sua forma ridotta è incolore, ma nella sua forma ossidata è colorato.
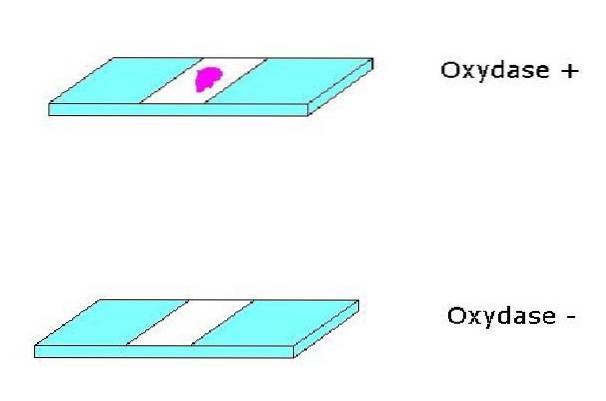
In questo modo viene evidenziata la presenza del sistema citocromo ossidasi c; poiché una reazione positiva genererà un colore lavanda o blu-viola a seconda del reagente utilizzato.
D'altra parte, se l'ultima sostanza che accetta gli elettroni nella catena respiratoria è diversa dall'ossigeno, il test dell'ossidasi sarà negativo (non c'è produzione di colore); questo è il caso dei microrganismi anaerobici.
Allo stesso modo, se il citocromo utilizzato dal microrganismo è diverso dalla citocromo ossidasi c, darà anche il test negativo..
Processi
Esistono vari reagenti e protocolli per il test dell'ossidasi, tutti per lo stesso scopo..
Reagenti
Reagente Kovacs, reagente Gordon e McLeod, reagente Nadi, reagente Carpenter, Suhrland e Morrison e uso di dischi ossidasi.
-Reagente Kovacs ossidasi
È costituito dall'1% di tetrametil-p-fenilendiammina dicloridrato.
Il reagente Kovacs viene preparato sciogliendo 1 g della suddetta sostanza in 50 ml di acqua distillata. Viene riscaldato leggermente fino a completa dissoluzione. Trasferire in una bottiglia color ambra di capacità sufficiente e portare il volume a 100 ml con acqua distillata. Attendere almeno 15 minuti prima dell'uso. Conservare in frigorifero al riparo dalla luce.
È etichettato come reagente ossidasi Kovacs, per differenziarlo dal reagente Kovacs utilizzato per rivelare il test dell'indolo. Questo reagente è il più sensibile, meno tossico ma più costoso del resto dei reagenti.
Una reazione positiva sarà evidenziata con questo reagente con il cambiamento di colore della colonia in lavanda, che diventa rapidamente viola quasi nero. Una reazione negativa è evidente perché non c'è cambiamento di colore nella colonia o assume una leggera colorazione rosata. Il mezzo può anche scurirsi, ma ciò non significa una reazione positiva.
Con questo reagente, il tempo di reazione è fondamentale, un cambiamento di colore che si verifica tra 5 e 15 secondi è considerato una reazione positiva..
-Il reagente di Gordon e McLeod
È composto da dimetil-p-fenilendiammina dicloridrato, noto anche come N-dimetil-p-fenilendiammina o p-amminodimetilanilina monocloridrato. Viene preparato come descritto per il reagente ossidasi Kovacs, sostituendo la sostanza coinvolta..
Questo reagente è leggermente più stabile del reagente ossidasi Kovacs, sebbene tutti i reagenti contenenti p-fenilendiammina siano instabili..
Questa reazione è successiva, viene interpretata come positiva con la comparsa di un colore blu-viola entro 10-30 minuti..
-Reagente Nadi
È composto da 1% di α-naftolo in alcool etilico (95% di etanolo) e 1% di amminodimetilanilina. La miscela viene preparata in parti uguali e utilizzando alcool etilico assoluto come diluente, fino a completare la quantità sufficiente per 100 ml.
-Reattivo di Carpenter, Suhrland e Morrison
È composto da 1% di ossalato di p-amminodimetilalanina. Preparare nello stesso modo descritto per il reagente ossidasi Kovacs, cambiando per la sostanza corrispondente.
Con la soluzione pronta, preparare le strisce reattive come segue: 6-8 cm strisce di carta da filtro Whatman n. 1 sono impregnate con reagente dimetil-p-fenilendiammina ossalato all'1%.
Si lasciano asciugare senza contatto con il metallo, si conservano in barattoli con tappo a vite con essiccante e si conservano in frigorifero. Queste strisce sono stabili fino a 6 mesi.
È il reagente più stabile di tutti quelli citati e può durare fino a 6 mesi in soluzione. Un altro punto a favore è che non colora il terreno intorno alla colonia, se viene utilizzato direttamente sul piatto.
L'aspetto di un colore rosso è interpretato come un test positivo.
-Dischi ossidasi
Sono dischi commerciali impregnati di reagente per il test dell'ossidasi. Ci sono diversi marchi commerciali sul mercato.
Il suo utilizzo è abbastanza pratico, poiché non è necessario preparare reagenti freschi, il che facilita il lavoro. I risultati ottenuti sono affidabili purché i dischi siano adeguatamente conservati.
Protocolli
Metodo diretto su piastra, metodo indiretto su carta e utilizzo di dischi impregnati di reagenti ossidasi.
-Metodo piastra diretta
A tale scopo vengono aggiunte 2 o 3 gocce di uno qualsiasi dei suddetti reagenti direttamente sulla o sulle colonie contenute in una piastra di terreno di coltura che non contiene glucosio..
Viene interpretato il cambiamento o meno del colore delle colonie, non del terreno. Il tempo di reazione valido dipende dal reagente utilizzato.
-Metodo indiretto su carta
Taglia un pezzo di carta da filtro (Whatman n. 1) a una dimensione di 6 cmDue e posto all'interno di una capsula di Petri vuota.
Aggiungere 2 o 3 gocce del reagente ossidasi Kovacs sulla carta, prendere parte della colonia da studiare con un manico di platino o uno stuzzicadenti di legno e stenderla in linea retta sulla carta impregnata di reagente. Esegui entro 5-10 secondi.
Con le strisce preparate con il reagente Carpenter, Suhrland e Morrison, una colonia viene stesa sulla striscia asciutta. Una singola striscia viene utilizzata per testare diversi ceppi. Interpreta in 10 sec.
-Dischi (mmetodo diretto)
Inumidire leggermente i dischi commerciali con acqua distillata sterile e sovrapporli alla colonia da studiare. Si consiglia di utilizzare le piastre a 35 ° C, se si utilizzano piastre a temperatura ambiente o piastre refrigerate la reazione è un po 'più lenta. Interpretare il cambio di colore tra 10 e 20 sec.
Possono essere utilizzate colonie contenute nel sangue o nell'agar cioccolato.
-Dischi (metodo indiretto)
Inumidire il disco come descritto in precedenza. Mettilo in una capsula di Petri vuota. Prendi una quantità sufficiente della colonia da studiare con un manico di platino o uno stuzzicadenti di legno e posiziona sul disco. Interpretare il cambio di colore tra 10 e 20 sec.
Uso
Il genere Neisseria e Acinetobacter sono talvolta molto simili morfologicamente perché anche se il genere Acinetobacter è un bastoncino Gram negativo, a volte può assumere una forma coccoide ed essere distribuito a coppie, simulando il genere Neisseria..
In questo caso il test dell'ossidasi è davvero utile. Il genere Neisseria è positivo e Acinetobacter negativo.
Tuttavia, il genere Moraxella è molto simile al genere Neisseria ed entrambi danno una reazione positiva; per questo motivo devono essere sempre eseguiti test di fermentazione dei carboidrati per l'identificazione definitiva.
D'altra parte, il test dell'ossidasi è utile per differenziare un batterio appartenente alla famiglia delle Enterobacteriaceae (tutte ossidasi negative) da altri fermentatori, come il genere Pasteurella, Aeromonas, Plesiomonas (ossidasi positive).
Anche il genere Vibrio e Helicobacter sono ossidasi positivi.
QA
Usa ceppi noti di Escherichia coli come controllo negativo e ceppi di Pseudomonas aeruginosa come controllo positivo.
Limitazioni
-I reagenti devono essere utilizzati appena preparati, la loro conservabilità in soluzione a temperatura ambiente è breve perché molto instabili. In frigorifero possono durare da 5 giorni a 2 settimane.
-I reagenti sono incolori, se cambiano colore devono essere eliminati. I dischi danneggiati sono evidenti perché si scuriscono nel tempo.
-Una reazione positiva con il reagente ossidasi Kovacs tra 15-60 secondi è considerata una reazione ritardata e dopo 60 secondi dovrebbe essere considerata negativa.
-Il Haemophylus influenzae dà una reazione ossidasi negativa se viene utilizzato un reagente con dimetil-p-fenilendiammina, ma positiva se viene utilizzato il reagente ossidasi di Kovacs (tetrametil-p-fenilendiammina).
-I terreni contenenti glucosio interferiscono con il test, dando falsi negativi.
-Ceppi di Bordetella pertussis possono dare una reazione falsa positiva se provengono da piastre di agar sangue altamente concentrate.
-L'uso di maniglie in metallo (ferro) dà una reazione falsa positiva.
raccomandazioni
-Poiché i reagenti sono molto instabili e tendono ad autoossidarsi, si consiglia di congelare aliquote da 1 a 2 ml e di rimuoverle secondo necessità..
-Un altro modo per ritardare l'autoossidazione del reagente è aggiungere lo 0,1% di acido ascorbico durante la preparazione dei reagenti..
-Poiché i reagenti sono instabili, si consiglia un controllo di qualità settimanale..
-I reagenti che non superano il test del controllo di qualità non devono essere utilizzati..
Riferimenti
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosi microbiologica. 5a ed. Editoriale Panamericana S.A. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott Microbiological Diagnosis. 12 ed. Editoriale Panamericana S.A. Argentina.
- "Oxidase Test." Wikipedia, l'enciclopedia libera. 15 gennaio 2018, 10:32 UTC. 3 aprile 2019, 14:03
- Organizzazione mondiale della Sanità. Manuale di laboratorio per l'identificazione e il test di sensibilità antimicrobica di batteri patogeni di importanza per la salute pubblica nel mondo in via di sviluppo.2004. Disponibile su: who.int/drugresistance/infosharing
- Strisce reattive per la diagnosi dell'attività dell'ossidasi nei batteri. Rev Cubana Med Trop [Internet]. 2000; 52 (2): 150-151.


Nessun utente ha ancora commentato questo articolo.