
Proprietà periodiche degli elementi e loro caratteristiche

Il Proprietà periodiche degli elementi sono quelli che definiscono il loro comportamento fisico e chimico da una prospettiva atomica, e le cui grandezze, oltre al numero atomico, consentono una classificazione degli atomi.
Tra tutte le proprietà, queste si caratterizzano, come indica il nome, per essere periodiche; cioè se si studia la tavola periodica sarà possibile certificare che le sue grandezze obbediscono ad un andamento che coincide e si ripete con l'ordinamento degli elementi in periodi (righe) e gruppi (colonne).

Ad esempio, se un periodo viene attraversato e una proprietà periodica diminuisce di grandezza con ogni elemento, lo stesso accadrà in tutti i periodi. D'altra parte, se la discesa di un gruppo o di una colonna ne aumenta la grandezza, ci si può aspettare lo stesso per gli altri gruppi..
E così, le sue variazioni si ripetono e mostrano una semplice tendenza che concorda con l'ordinamento degli elementi in base ai loro numeri atomici. Queste proprietà sono direttamente responsabili del carattere metallico o non metallico degli elementi, nonché della loro reattività, che ha contribuito a classificarli in modo più approfondito..
Se per un momento l'identità degli elementi fosse sconosciuta e fossero visti come strane "sfere", la tavola periodica potrebbe essere ricostruita (con molto lavoro) facendo uso di queste proprietà.
In questo modo, le presunte sfere acquisirebbero colori che permetterebbero di differenziarle tra loro in gruppi (immagine in alto). Conoscendo le loro caratteristiche elettroniche, potrebbero essere organizzati in periodi, ei gruppi rivelerebbero quelli che hanno lo stesso numero di elettroni di valenza.
Imparare e ragionare sulle proprietà periodiche equivale a sapere perché gli elementi reagiscono in un modo o nell'altro; è sapere perché gli elementi metallici si trovano in alcune regioni del tavolo e gli elementi non metallici in un'altra.
Indice articolo
- 1 Quali sono le proprietà periodiche e le loro caratteristiche
- 1.1 -Raggio atomico
- 1.2 -Elettronegatività
- 1.3-Carattere metallico
- 1.4 -Energia di ionizzazione
- 1.5 - Affinità elettronica
- 2 Riferimenti
Quali sono le proprietà periodiche e le loro caratteristiche
-Radio atomica
Osservando le sfere nell'immagine, la prima cosa che si nota è che non sono tutte della stessa dimensione. Alcuni sono più voluminosi di altri. Se guardi più da vicino, scoprirai che queste dimensioni variano secondo uno schema: in un periodo diminuisce da sinistra a destra, e in un gruppo aumenta dall'alto verso il basso..
Quanto sopra può anche essere detto in questo modo: il raggio atomico diminuisce verso i gruppi o le colonne a destra e aumenta nei periodi o nelle righe inferiori. Stando così le cose, il raggio atomico è la prima proprietà periodica, poiché le sue variazioni seguono uno schema all'interno degli elementi..
Carica nucleare vs elettroni
Perché questo modello? In un periodo gli elettroni dell'atomo occupano lo stesso livello di energia, che è correlato alla distanza che li separa dal nucleo. Quando ci spostiamo da un gruppo all'altro (che equivale a passare attraverso il periodo a destra), il nucleo aggiunge sia elettroni che protoni entro lo stesso livello di energia..
Pertanto, gli elettroni non possono occupare ulteriori distanze dal nucleo, il che aumenta la sua carica positiva perché ha più protoni. Di conseguenza, gli elettroni sperimentano una maggiore forza di attrazione verso il nucleo, attirandoli sempre di più all'aumentare del numero di protoni..
Ecco perché gli elementi all'estrema destra della tavola periodica (colonne gialle e turchesi) hanno i raggi atomici più piccoli..
D'altra parte, quando "salti" da un periodo all'altro (che è come dire che scendi in un gruppo), i nuovi livelli di energia abilitati consentono agli elettroni di occupare spazi più distanti dal nucleo. Essendo più lontano, il nucleo (con più protoni) li attrae con meno forza; e quindi i raggi atomici aumentano.
Raggi ionici
I raggi ionici seguono un modello simile ai raggi atomici; Tuttavia, questi non dipendono tanto dal nucleo, ma da quanti o meno elettroni ha l'atomo rispetto al suo stato neutro.
I cationi (Na+, ACDue+, Al3+, EssereDue+, Fede3+) mostrano una carica positiva perché hanno perso uno o più elettroni e, quindi, il nucleo li attrae con maggiore forza poiché ci sono meno repulsioni tra di loro. Il risultato: i cationi sono più piccoli degli atomi da cui derivano.
E per gli anioni (ODue-, F-, SDue-, io-) al contrario, esibiscono carica negativa perché hanno uno o più elettroni in eccesso, aumentando le loro repulsioni reciproche al di sopra dell'attrazione esercitata dal nucleo. Il risultato: gli anioni sono più grandi degli atomi da cui derivano (immagine sotto).
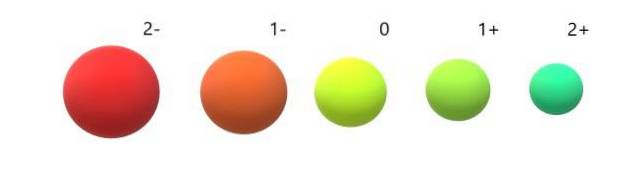
Si apprezza che il 2-anione sia il più voluminoso di tutti e il catione 2+ il più piccolo. I raggi aumentano quando l'atomo è caricato negativamente e si contrae quando è caricato positivamente..
-Elettronegatività
Quando gli elementi hanno raggi atomici piccoli, non solo i loro elettroni sono attratti molto fortemente, ma anche gli elettroni dagli atomi vicini quando formano un legame chimico. Questa tendenza ad attrarre elettroni da altri atomi all'interno di un composto è nota come elettronegatività..
Solo perché un atomo è piccolo non significa che sarà più elettronegativo. Se è così, gli elementi elio e idrogeno sarebbero gli atomi più elettronegativi. L'elio, per quanto la scienza ha dimostrato, non forma un legame covalente di alcun tipo; e l'idrogeno, ha solo un singolo protone nel nucleo.
Quando i raggi atomici sono grandi, i nuclei non hanno abbastanza forza per attrarre elettroni da altri atomi; quindi, gli elementi più elettronegativi sono quelli con un piccolo raggio atomico e un maggior numero di protoni.
Ancora una volta, quelli che soddisfano perfettamente queste caratteristiche sono gli elementi non metallici del blocco p della tavola periodica; Questi sono quelli appartenenti al gruppo 16 o ossigeno (O, S, Se, Te, Po) e al gruppo 17 o fluoro (F, Cl, Br, I, At).
Tendenza
Secondo quanto detto, gli elementi più elettronegativi si trovano soprattutto nell'angolo in alto a destra della tavola periodica; avendo fluoro come l'elemento che è in cima alla lista dei più elettronegativi.
Perché? Senza ricorrere a scale di elettronegatività (Pauling, Mulliken, ecc.), Sebbene il fluoro sia più grande del neon (il gas nobile del suo periodo), il primo può formare legami mentre il secondo no. Inoltre, per le sue piccole dimensioni, il suo nucleo ha molti protoni e dove c'è il fluoro ci sarà un momento di dipolo.
-Carattere metallico
Se un elemento ha un raggio atomico rispetto a quelli del suo stesso periodo, ed è anche poco elettronegativo, allora è un metallo, e ha un alto carattere metallico.
Se torniamo all'immagine principale, le sfere rossastre e verdastre, come quelle grigiastre, corrispondono ad elementi metallici. I metalli hanno caratteristiche uniche, e da qui le proprietà periodiche iniziano a intrecciarsi con le proprietà fisiche e macroscopiche della materia..
Gli elementi con un alto carattere metallico sono caratterizzati dai loro atomi relativamente grandi, facili da perdere elettroni poiché i nuclei difficilmente possono attrarli a loro..
Di conseguenza, sono elettroni facilmente ossidati o persi per formare cationi, M.+; questo non significa che tutti i cationi siano metallici.
Tendenza
A questo punto puoi prevedere come varia il carattere metallico nella tavola periodica. Se è noto che i metalli hanno grandi raggi metallici, e che sono anche pochi elettronegativi, ci si dovrebbe aspettare che gli elementi più pesanti (i periodi inferiori) siano i più metallici; e gli elementi più leggeri (i periodi superiori), i meno metallici.
Inoltre, il carattere metallico diminuisce quanto più l'elemento diventa elettronegativo. Ciò significa che passando per i periodi e gruppi a destra della tavola periodica, nei loro periodi superiori, troveranno gli elementi meno metallici..
Pertanto, il carattere metallico aumenta scendendo attraverso un gruppo e diminuisce da sinistra a destra nello stesso periodo. Tra gli elementi metallici abbiamo: Na (sodio), Li (litio), Mg (magnesio), Ba (bario), Ag (argento), Au (oro), Po (polonio), Pb (piombo), Cd (cadmio ), Al (alluminio), ecc.
-Energia ionizzata
Se un atomo ha un ampio raggio atomico, ci si può aspettare che il suo nucleo non trattiene gli elettroni nei gusci più esterni intrappolati con una forza considerevole. Di conseguenza, rimuoverli dall'atomo in fase gassosa (individualizzata) non richiederà molta energia; cioè l'energia di ionizzazione, EI, necessaria per rimuovere un elettrone da essi.
EI equivale anche a dire che è l'energia che deve essere fornita per vincere la forza di attrazione del nucleo di un atomo o ione gassoso sul suo elettrone più esterno. Più piccolo è l'atomo e più elettronegativo, minore è il suo EI; questa è la tua tendenza.
La seguente equazione illustra un esempio:
Na (g) => Na+(g) + e-
L'EI necessaria per ottenere questo risultato non è eccezionale rispetto alla seconda ionizzazione:
N / A+(g) => NaDue+(g) + e-
Dal momento che in Na+ predominano le cariche positive e lo ione è più piccolo dell'atomo neutro. Di conseguenza, il nucleo di Na+ attrae gli elettroni con una forza molto maggiore, richiedendo un EI molto più grande.
-Affinità elettronica
E infine, c'è la proprietà periodica dell'affinità elettronica. Questa è la tendenza energetica dell'atomo di un elemento in fase gassosa ad accettare un elettrone. Se l'atomo è piccolo e ha un nucleo con una grande forza attrattiva, sarà facile per lui accettare l'elettrone, formando un anione stabile..
Più stabile è l'anione rispetto al suo atomo neutro, maggiore è la sua affinità elettronica. Tuttavia, entrano in gioco anche le repulsioni tra gli elettroni stessi.
L'azoto, ad esempio, ha un'affinità elettronica maggiore dell'ossigeno. Questo perché i suoi tre elettroni 2p non sono accoppiati e si respingono a vicenda e l'elettrone in arrivo è inferiore; mentre nell'ossigeno c'è una coppia di elettroni accoppiati che esercitano una maggiore repulsione elettronica; e nel fluoro, ci sono due coppie.
È per questo motivo che si dice che l'andamento delle affinità elettroniche si normalizzi a partire dal terzo periodo della tavola periodica..
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Prof. Ortega Graciela M. (1 aprile 2014). Proprietà periodiche degli elementi. Colore abc. Estratto da: abc.com.py
- Chemistry LibreTexts. (7 giugno 2017). Proprietà periodiche degli elementi. Recupero da: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (02 gennaio 2019). Le proprietà periodiche degli elementi. Estratto da: thoughtco.com
- Toppr. (s.f.). Proprietà periodiche degli elementi. Estratto da: toppr.com /
- Proprietà periodiche degli elementi: un viaggio attraverso la tavola è un viaggio attraverso la chimica. [PDF]. Recupero da: cod.edu



Nessun utente ha ancora commentato questo articolo.