
Proprietà colligative (con formule)
Il proprietà colligativa è una qualsiasi proprietà di una sostanza che dipende o varia a seconda del numero di particelle presenti in essa (sotto forma di molecole o atomi), senza dipendere dalla natura di tali particelle.
In altre parole, questi possono anche essere spiegati come proprietà delle soluzioni che dipendono dalla relazione tra il numero di particelle di soluto e il numero di particelle di solvente. Questo concetto fu introdotto nel 1891 dal chimico tedesco Wilhelm Ostwald, che classificò le proprietà del soluto in tre categorie.

Queste categorie affermavano che le proprietà colligative dipendevano esclusivamente dalla concentrazione e dalla temperatura del soluto e non dalla natura delle sue particelle..
Inoltre, le proprietà additive come la massa dipendevano dalla composizione del soluto e le proprietà costituzionali dipendevano maggiormente dalla struttura molecolare del soluto..
Indice articolo
- 1 Proprietà colligative
- 1.1 Diminuzione della pressione del vapore
- 1.2 Aumentare la temperatura di ebollizione
- 1.3 Abbassare la temperatura di congelamento
- 1.4 Pressione osmotica
- 2 Riferimenti
Proprietà colligative
Le proprietà colligative sono studiate principalmente per soluzioni diluite (a causa del loro comportamento quasi ideale), e sono le seguenti:
Diminuzione della pressione del vapore
Si può dire che la tensione di vapore di un liquido è la pressione di equilibrio delle molecole di vapore con cui quel liquido è a contatto.
Allo stesso modo, la relazione di queste pressioni è spiegata con la legge di Raoult, che esprime che la pressione parziale di un componente è uguale al prodotto della frazione molare del componente per la tensione di vapore del componente allo stato puro:
PPER = XPER . PºPER
In questa espressione:
PPER = Pressione di vapore parziale del componente A nella miscela.
XPER = Frazione molare del componente A.
PºPER= Pressione di vapore del componente A puro.
Nel caso della diminuzione della tensione di vapore di un solvente, ciò si verifica quando ad esso viene aggiunto un soluto non volatile per formare una soluzione. Come è noto e per definizione, una sostanza non volatile non ha tendenza ad evaporare.
Per questo motivo, più questo soluto viene aggiunto al solvente volatile, minore sarà la tensione di vapore e meno solvente potrà fuoriuscire per diventare uno stato gassoso..
Quindi, quando il solvente evapora naturalmente o forzatamente, una quantità di solvente rimarrà finalmente senza evaporare insieme al soluto non volatile..
Questo fenomeno può essere meglio spiegato con il concetto di entropia: quando le molecole effettuano un passaggio dalla fase liquida a quella gassosa, l'entropia del sistema aumenta..
Ciò significa che l'entropia di questa fase gassosa sarà sempre maggiore di quella dello stato liquido, perché le molecole di gas occupano un volume maggiore..
Quindi, se l'entropia dello stato liquido aumenta per diluizione, anche se è legata a un soluto, la differenza tra i due sistemi diminuisce. Per questo motivo, la diminuzione dell'entropia diminuisce anche la tensione di vapore..
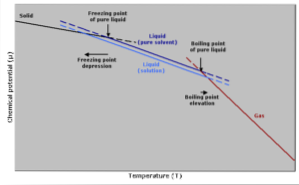
Aumento della temperatura di ebollizione
Il punto di ebollizione è quella temperatura alla quale c'è equilibrio tra la fase liquida e quella gassosa. A questo punto, il numero di molecole di gas che diventano liquide (condensanti) è uguale al numero di molecole liquide che evaporano in gas..
L'aggiunta di un soluto provoca la diluizione della concentrazione di molecole liquide, provocando una diminuzione della velocità di evaporazione. Questo genera una variazione del punto di ebollizione, per compensare la variazione della concentrazione del solvente..
In altre parole più semplici, la temperatura di ebollizione di una soluzione è superiore a quella del solvente allo stato puro. Questo è espresso da un'espressione matematica mostrata di seguito:
ΔTb = i. Kb . m
In questa espressione:
ΔTb = Tb (soluzione) - Tb (solvente) = Variazione della temperatura di ebollizione.
i = fattore di van't Hoff.
Kb = Costante di ebollizione del solvente (0,512 ºC / molal per l'acqua).
m = Molalità (mol / kg).
Riduzione della temperatura di congelamento
La temperatura di congelamento di un solvente puro diminuirà quando viene aggiunta una quantità di soluto, poiché è influenzata dallo stesso fenomeno della diminuzione della tensione di vapore..
Ciò accade perché, diminuendo la tensione di vapore del solvente diluendo un soluto, sarà necessaria una temperatura inferiore per farlo congelare..
Anche la natura del processo di congelamento può essere presa in considerazione per spiegare questo fenomeno: perché un liquido si congeli, deve raggiungere uno stato ordinato in cui finisce per formare cristalli..
Se ci sono impurità all'interno del liquido sotto forma di soluti, il liquido sarà meno ordinato. Per questo motivo, la soluzione avrà maggiori difficoltà a congelare rispetto a un solvente senza impurità..
Questa riduzione è espressa come:
ΔTF = -i. KF . m
Nell'espressione sopra:
ΔTF = TF (soluzione) - TF (solvente) = Variazione della temperatura di congelamento.
i = fattore di van't Hoff.
KF = Costante di congelamento del solvente (1,86 ºC kg / mol per l'acqua).
m = Molalità (mol / kg).
Pressione osmotica
Il processo noto come osmosi è la tendenza di un solvente a passare attraverso una membrana semipermeabile da una soluzione all'altra (o da un solvente puro a una soluzione).
Questa membrana rappresenta una barriera attraverso la quale alcune sostanze possono passare e altre no, come nel caso delle membrane semipermeabili nelle pareti cellulari delle cellule animali e vegetali..
La pressione osmotica è quindi definita come la pressione minima che deve essere applicata ad una soluzione per bloccare il passaggio del suo solvente puro attraverso una membrana semipermeabile..
È anche noto come misura della tendenza di una soluzione a ricevere il solvente puro per effetto dell'osmosi. Questa proprietà è colligativa poiché dipende dalla concentrazione di soluto nella soluzione, che è espressa come espressione matematica:
Π. V = n. R. T, o anche π = M. R. T
In queste espressioni:
n = Numero di moli di particelle nella soluzione.
R = Costante dei gas universale (8.314472 J. K-1 . Talpa-1).
T = Temperatura in Kelvin.
M = Molarità.
Riferimenti
- Wikipedia. (s.f.). Proprietà colligative. Estratto da en.wikipedia.org
- AVANTI CRISTO. (s.f.). Proprietà colligative. Recuperato da opentextbc.ca
- Bosma, W. B. (s.f.). Proprietà colligative. Estratto da chemistryexplained.com
- Sparknotes. (s.f.). Proprietà colligative. Recupero da sparknotes.com
- Università, F. S. (s.f.). Proprietà colligative. Estratto da chem.fsu.edu



Nessun utente ha ancora commentato questo articolo.