
Proprietà, struttura, usi, rischi dell'ossalato di calcio (CaC2O4)
Il ossalato di calcio È un composto organico formato dagli elementi carbonio (C), ossigeno (O) e calcio (Ca). La sua formula chimica è CaCDueO4. Si trova generalmente nelle sue tre forme idratate: mono-, di- e triidrato. Cioè, rispettivamente con una, due o tre molecole di acqua nella sua struttura cristallina..
L'ossalato di calcio si trova in minerali, piante, funghi e altri esseri viventi come i mammiferi e persino negli esseri umani come conseguenza del metabolismo di alcune proteine. Può essere trovato nelle urine degli esseri umani e di alcuni animali.
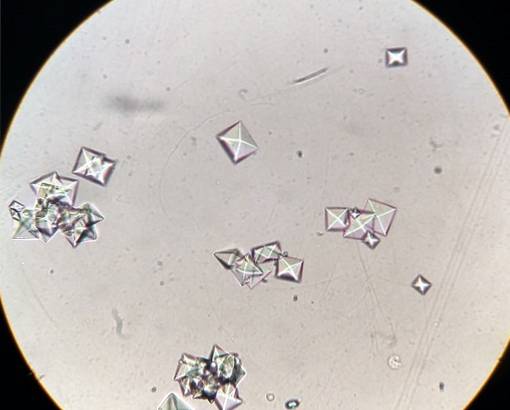
Alcuni alimenti come spinaci, rabarbaro, soia e cioccolato contengono molti ossalati e quando le persone sensibili li mangiano, i calcoli di ossalato di calcio possono formarsi nei loro reni..
I calcoli CaC possono essere prevenutiDueO4 nei reni se ingeriscono molti liquidi, soprattutto acqua, evitando cibi ricchi di ossalati e consumando quelli ricchi di calcio e magnesio.
L'ossalato di calcio forma incrostazioni indesiderate nei tubi e nei serbatoi in processi come la produzione di pasta di legno e carta e anche nei birrifici.
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Peso specifico
- 3.5 Solubilità
- 3,6 pH
- 3.7 Proprietà chimiche
- 4 Presenza in natura
- 4.1 Nei minerali
- 4.2 In piante e funghi
- 5 Presenza nel corpo umano e nei mammiferi
- 5.1 Negli esseri umani
- 5.2 Fattori che influenzano l'aspetto delle pietre nei reni
- 5.3 Modi per evitare la formazione di calcoli di ossalato di calcio
- 5.4 Negli animali
- 5.5 Risposta del corpo all'eccesso di ossalato
- 6 Usi
- 6.1 Problemi in alcuni processi
- 7 Rischi
- 8 Riferimenti
Struttura
L'ossalato di calcio è formato dallo ione calcio CaDue+ e lo ione ossalato CDueO4Due-. L'anione ossalato è costituito da due atomi di carbonio e quattro atomi di ossigeno. Le cariche negative dell'anione ossalato si trovano sugli atomi di ossigeno.
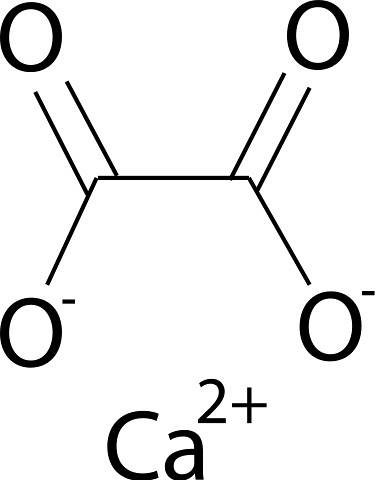
Nomenclatura
- Ossalato di calcio
- Sale di calcio dell'acido ossalico
- Sale di calcio dell'acido etandioico
Proprietà
Stato fisico
Solido cristallino incolore, bianco, giallo o marrone che può essere in tre diverse forme idratate.
Peso molecolare
128,1 g / mol
Punto di fusione
L'ossalato di calcio monoidrato si decompone a 200 ° C.
Peso specifico
Monoidrato CaCDueO4 •HDueO = 2,22 g / cm3
CaC diidratoDueO4 •2HDueO = 1,94 g / cm3
CaC triidratoDueO4 •3HDueO = 1,87 g / cm3
Solubilità
Quasi insolubile in acqua: 0.00061 g / 100 g di acqua a 20 ° C. Il monoidrato si dissolve in acido diluito.
pH
Le soluzioni acquose di ossalato di calcio sono debolmente basiche.
Proprietà chimiche
L'ossalato di calcio è il sale di calcio dell'acido ossalico. Questo è un sottoprodotto naturale del metabolismo, quindi è molto abbondante nel corpo umano e fa parte di molti alimenti.
L'acido ossalico e la sua base coniugata, l'ossalato, sono composti organici altamente ossidati, con potente attività chelante, cioè possono facilmente combinarsi con ioni positivi con cariche di +2 o +3.
Le sue soluzioni acquose sono debolmente basiche perché lo ione ossalato tende ad assorbire protoni H.+ dall'acqua, che rilascia ioni OH-. Dopo aver preso due protoni H.+ lo ione ossalato diventa acido ossalico HDueCDueO4:
CDueO4Due- + HDueO → HCDueO4- + Oh-
HCDueO4- + HDueO → HDueCDueO4 + Oh-
Presenza in natura
In minerali
L'ossalato di calcio è l'ossalato più comune e si presenta sotto forma di minerali come whewellite, weddellite e caoxite..
La whewellite è il CaC monoidratoDueO4 •HDueOppure ed è la più stabile delle forme di questo composto.

La Weddellite è il CaC diidratoDueO4 •2HDueO ed è meno stabile del monoidrato.

La caoxite è ossalato di calcio triidrato CaCDueO4 •3HDueO.
Nelle piante e nei funghi
L'ossalato di calcio si trova associato a suoli asciutti e foglie, anche a funghi patogeni, liberi, in simbiosi o associati a piante. In quest'ultimo, i cristalli si formano dalla precipitazione del calcio sotto forma del suo ossalato..
Formazione di CaCDueO4 dai funghi ha un'influenza importante sui processi biologici e geochimici dei suoli, poiché costituisce una riserva di calcio per l'ecosistema.
Presenza nel corpo umano e nei mammiferi
L'ossalato ha origine nel fegato, nei globuli rossi o negli eritrociti e, in misura minore, nel rene. È formato dal metabolismo degli amminoacidi (come fenilalanina e triptofano) e dall'ossidazione della dialdeide gliossale,.
Anche la vitamina C può essere convertita in ossalato quando svolge la sua funzione antiossidante.
L'ossalato di calcio si trova nelle pietre che si formano nei reni di persone o animali con malattie renali..
Le cosiddette pietre o pietre di ossalato di calcio sono formate dalla cristallizzazione o aggregazione di CaCDueO4 nelle urine sovrasaturate con calcio e ossalato. Ciò significa che l'urina contiene così tanto calcio e ossalato che non è possibile che questo composto rimanga disciolto, ma piuttosto precipiti o passi allo stato solido sotto forma di cristalli..
Negli umani
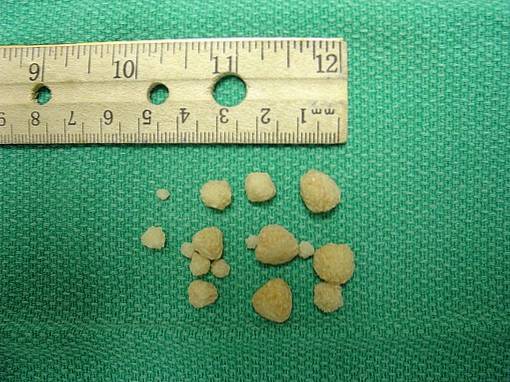
La formazione di sabbia o calcoli nei reni è una malattia chiamata nefrolitiasi; attacca circa il 10% della popolazione e circa il 75% di questi calcoli è composto da ossalato di calcio CaCDueO4.
La formazione e la crescita di cristalli di ossalato di calcio nel rene si verificano perché in alcune persone l'urina è sovrasatura di questo sale. L'ossalato di calcio si sviluppa nelle urine acide a pH inferiore a 6,0.
La sovrasaturazione si verifica quando l'escrezione o l'eliminazione di questo sale (che è molto scarsamente solubile in acqua) nelle urine avviene in un piccolo volume d'acqua..
Fattori che influenzano l'aspetto delle pietre nei reni
Tra i fattori che favoriscono la formazione della graniglia di ossalato di calcio ci sono l'eccesso di calcio nelle urine o l'ipercalciuria, l'eccesso di ossalato nelle urine o l'iperossaluria, elementi derivati dalla dieta e l'assenza di inibitori.
L'ossalato in eccesso può verificarsi quando si mangiano quantità elevate di spinaci, rabarbaro, soia, noci e cioccolato, tra gli altri alimenti..

Tuttavia, ci sono sostanze che inibiscono o impediscono la formazione di calcoli. I composti che impediscono la formazione di calcoli includono piccole molecole come citrato e pirofosfato e molecole grandi come glicoproteine e proteoglicani..
Modi per evitare la formazione di calcoli di ossalato di calcio
Una buona strategia per prevenire il ripetersi di calcoli di grinta o ossalato di calcio include aumentare l'assunzione di liquidi, aumentare l'assunzione di cibi ricchi di calcio (come i latticini) e limitare il sale da cucina (NaCl), proteine animali e alimenti ricchi di ossalato.
Negli animali
Dall'inizio del 2000, è stato osservato un aumento dei calcoli di ossalato di calcio nel sistema urinario di cani e gatti. Sembra che ciò dipenda dal tipo di dieta che questi animali mangiano e abbia a che fare con l'acidità delle urine e la carenza di magnesio (Mg).
Risposta del corpo all'eccesso di ossalato
Ci sono prove che sia gli esseri umani che gli animali rispondono all'eccesso di ossalato aumentando il numero di batteri che possono abbattere l'ossalato..
Alcuni di questi batteri lo sono Oxalobacter formigenes, Bifidobacterium sp., Porphyromonas gingivalis Y Bacillus sp., tra gli altri e sono naturalmente presenti nell'intestino.
Applicazioni
Secondo le fonti consultate, l'ossalato di calcio è utilizzato nel rivestimento ceramico.
È stato utilizzato per rivestire sculture in pietra calcarea e altri elementi artistici, ed è stato scoperto che migliora la durezza del materiale, diminuisce la sua porosità e aumenta la sua resistenza agli acidi e agli alcali..

Problemi in alcuni processi
Nell'industria della pasta di legno e della carta, l'ossalato di calcio può formare incrostazioni che causano molti problemi nel processo..
Per prevenirne la formazione nelle condotte o tubazioni dei processi industriali è stata proposta la degradazione enzimatica dell'acido ossalico, mediante enzimi quali l'ossalato ossidasi..
Inoltre tende ad accumularsi come pietra nei contenitori dove viene prodotta la birra, da dove deve essere eliminata per evitare la formazione di microrganismi che possono dare un sapore sgradevole alla bevanda..
Rischi
In alte concentrazioni, l'ossalato può causare la morte negli animali e occasionalmente nell'uomo, principalmente a causa dei suoi effetti corrosivi..
L'accumulo di ossalato e del suo acido coniugato, acido ossalico, può causare disturbi come malfunzionamento cardiaco, calcoli di ossalato di calcio, insufficienza renale e persino morte per tossicità.
Riferimenti
- Glasauer, S.M. et al. (2013). Metalli e metalloidi, trasformazione da microrganismi. Ossalati. In Modulo di riferimento in Sistemi terrestri e scienze ambientali. Recupero da sciencedirect.com.
- Baumann, J. M. e Casella, R. (2019). Prevenzione della nefrolitiasi del calcio: l'influenza della diuresi sulla cristallizzazione dell'ossalato di calcio nelle urine. Adv Prev Med, 2019; 2019: 3234867. Recuperato da ncbi.nlm.nih.gov.
- Breshears, M.A. e Confer, A.W. (2017). Il sistema urinario. Calcoli di ossalato di calcio. In Pathologic Basis of Veterinary Disease (Sesta Edizione). Recupero da sciencedirect.com.
- Huang, Y. er al. (2019). Trattamento dell'ossalato nel corpo e origine dell'ossalato nelle pietre di ossalato di calcio. Urol Int, 5 dicembre 2019: 1-10. Recupero da ncbi.nlm.nih.gov.
- Nilvebrant, N.-O. et al. (2002). Biotecnologie nell'industria della pasta di legno e della carta. In Progress in Biotechnology. Recupero da sciencedirect.com.
- Pahira, J.J. e Pevzner, M. (2007). Nefrolitiasi. Pietre di calcio. In Penn Clinical Manual of Urology. Recupero da sciencedirect.com.
- Worcester, E. M. (1994). Inibitori della crescita dei cristalli di ossalato di calcio urinario. J Am Soc Nephrol 1994 Nov; 5 (5 Suppl 1): S46-53). Recuperato da jasn.asnjournals.org.
- Finkielstein, V.A. e Goldfarb, D.S. (2006). Strategie per prevenire i calcoli di ossalato di calcio. Recupero da ncbi.nlm.nih.gov.
- NOI. Biblioteca nazionale di medicina. (2019). Ossalato di calcio. Recupero da pubchem.ncbi.nlm.nih.gov.
- Peck, A.B. et al. (2015). Microrganismi che degradano l'ossalato o enzimi che degradano l'ossalato: qual è la futura terapia per la dissoluzione enzimatica degli uroliti di ossalato di calcio nella malattia ricorrente della pietra? Urolitiasi, febbraio 2016; 44 (1): 27-32. Recupero da ncbi.nlm.nih.gov.
- Holames, R.P. et al. (2016). Abbassare l'escrezione urinaria di ossalato per diminuire la malattia dei calcoli di ossalato di calcio. Urolitiasi. 2016 febbraio; 44 (1); 27-32. Recupero da ncbi.nlm.nih.gov.
- Cezar, T.M. (1998). Ossalato di calcio: un trattamento superficiale per il calcare. Journal of Conservation and Museum Studies 4, pp. 6-10. Recuperato da jcms-journal.com.
- Wikimedia (2019). Ossalato di calcio. Estratto da en.wikipedia.org.



Nessun utente ha ancora commentato questo articolo.