
I numeri quantici a cosa servono ea cosa servono

Il nnumeri quantici sono usati per descrivere lo stato quantistico degli elettroni nell'atomo e provengono dalla soluzione dell'equazione di Schrödinger per la più semplice di tutte: l'idrogeno.
L'equazione di Schrödinger è un'equazione differenziale, le cui soluzioni sono funzioni d'onda e sono indicati dalla lettera greca ψ. Si possono proporre soluzioni infinite e il loro quadrato è uguale alla probabilità di trovare l'elettrone in una piccola regione dello spazio, chiamata orbitale.
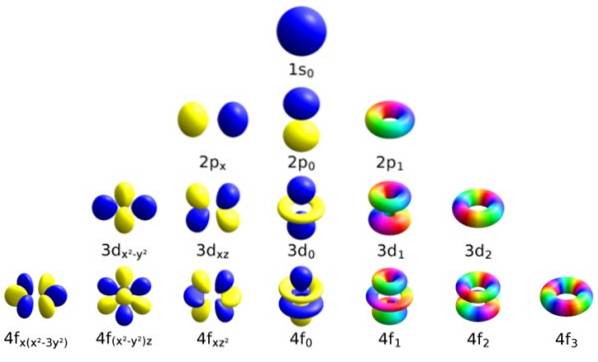
Ogni orbitale ha caratteristiche definite che lo distinguono dagli altri, come l'energia, il momento angolare e lo spin, una proprietà interamente quantistica dell'elettrone e che è responsabile, tra le altre cose, degli effetti magnetici..
Il modo per identificare ogni orbitale è distinguerlo da un insieme di numeri che lo descrivono, e questi sono precisamente i numeri quantici:
-n: è il numero quantico principale.
-ℓ: il numero quantico azimutale.
-mℓ, è il numero magnetico.
-mS, il numero di rotazione.
Indice articolo
- 1 A cosa servono i numeri quantici?
- 1.1 Funzioni d'onda
- 2 Cosa sono i numeri quantici?
- 2.1 Numero quantico principale
- 2.2 Numero quantico azimutale o momento angolare
- 2.3 Numero quantico magnetico mℓ
- 2.4 Numero quantico di rotazione ms
- 3 Riferimenti
A cosa servono i numeri quantici?
I numeri quantici sono usati per descrivere lo stato degli elettroni all'interno dell'atomo. Quel modello atomico in cui l'elettrone ruota attorno al nucleo è impreciso, perché non è coerente con la stabilità atomica o con un gran numero di fenomeni fisici osservati.
Ecco perché il danese Niels Bohr (1885-1962) fece un'audace proposta nel 1913: l'elettrone può essere trovato solo in certe orbite stabili, la cui dimensione dipende da un numero intero chiamato n.
Successivamente, nel 1925, anche il fisico austriaco Erwin Schrödinger (1887-1961) propose un'equazione differenziale in derivate parziali, le cui soluzioni descrivono l'atomo di idrogeno. Sono le funzioni d'onda ψ menzionate all'inizio.
Questa equazione differenziale include le tre coordinate spaziali più il tempo, ma quando questo non è incluso, la soluzione dell'equazione di Schrödinger è analoga a quella di un'onda stazionaria (un'onda che si propaga tra certi limiti).
Funzioni d'onda
L'equazione di Schrödinger indipendente dal tempo viene risolta in coordinate sferiche e la soluzione viene scritta come il prodotto di tre funzioni, una per ogni variabile spaziale. In questo sistema di coordinate, invece di utilizzare le coordinate degli assi cartesiani X, Y Y z vengono utilizzate le coordinate r, θ Y φ. In questo modo:
ψ (r, θ, φ) = R (r) ⋅f (θ) ⋅g (φ)
La funzione d'onda è intangibile, tuttavia la meccanica quantistica ci dice che l'ampiezza al quadrato:
| ψ (r, θ, φ) |Due
Cioè, il modulo o valore assoluto della funzione d'onda, al quadrato, è un numero reale che rappresenta la probabilità di trovare l'elettrone, in una certa regione attorno al punto le cui coordinate sono r, θ Y φ.
E questo fatto è qualcosa di più concreto e tangibile.
Per trovare la funzione d'onda, devi risolvere tre equazioni differenziali ordinarie, una per ogni variabile r, θ Y φ.
Le soluzioni di ciascuna equazione, che saranno le funzioni R (r), f (θ) eg (φ), contengono i primi tre numeri quantici menzionati.
Cosa sono i numeri quantici?
Descriviamo brevemente la natura di ciascun numero quantico di seguito. I primi tre, come detto in precedenza, derivano dalle soluzioni dell'equazione di Schrödinger.
Il quarto numero fu aggiunto da Paul Dirac (1902-1984) nel 1928.
Numero quantico principale
È indicato da n e indica la dimensione dell'orbitale consentito, nonché l'energia dell'elettrone. Più alto è il suo valore, più l'elettrone è lontano dal nucleo e anche la sua energia sarà maggiore, ma in cambio riduce la sua stabilità.
Questo numero deriva dalla funzione R (r), che è la probabilità di trovare l'elettrone a una certa distanza r del nucleo, che è determinato da:
-Costante di Planck: h = 6,626 × 10 -3. 4 J.s
-Massa elettronica me = 9,1 × 10-31 kg
-Carica elettronica: e = 1,6 × 10-19 C.
-Costante elettrostatica: k = 9 × 10 9 N.mDue/ CDue
Quando n = 1 corrisponde al raggio di Bohr che è circa 5,3 × 10−11 m.
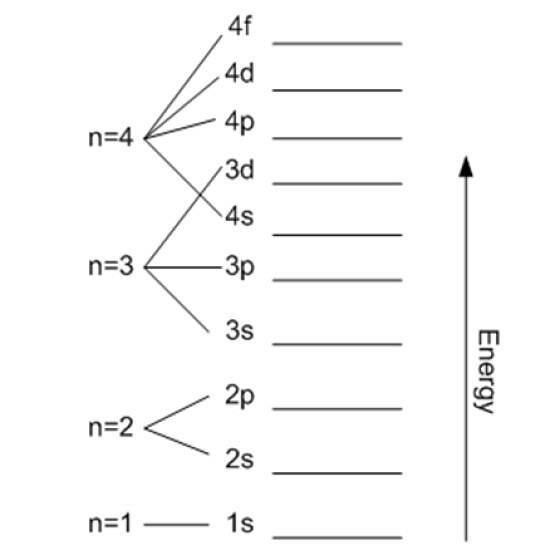
Ad eccezione del primo livello, gli altri sono suddivisi in sottolivelli o sottolivelli. Ogni shell ha un'energia in elettronvolt data da:

- K (n = 1)
- L (n = 2)
- M (n = 3)
- N (n = 4)
- O (n = 5)
- P (n = 6)
- Q (n = 7).
In teoria non esiste un limite superiore per n, ma in pratica si osserva che raggiunge solo n = 8. L'energia più bassa possibile corrisponde a n = 1 ed è quella del stato fondamentale.
Numero quantico del momento azimutale o angolare
Indicato dalla lettera corsiva ℓ, questo numero determina la forma degli orbitali, quantificando l'ampiezza del momento angolare orbitale dell'elettrone.
Può assumere valori positivi e interi compresi tra 0 e n-1, ad esempio:
-Quando n = 1, allora ℓ = 0 e c'è un solo sottolivello.
-Se n = 2, allora ℓ può essere uguale a 0 o 1, quindi abbiamo due sottolivelli.
-E se n = 3, allora ℓ assume i valori 0, 1 e 2 e ci sono 3 sottolivelli.
Può essere continuato in questo modo indefinitamente, anche se come detto prima, in pratica n va fino a 8. I sottolivelli sono indicati con le lettere: S, p, d, F Y g e stanno aumentando di energia.

Numero quantico magnetico mℓ
Questo numero decide l'orientamento dell'orbitale nello spazio e il suo valore dipende da quello di ℓ.
Per un dato ℓ, ci sono (2ℓ + 1) valori interi di m ℓ, che corrispondono ai rispettivi orbitali. Questi sono:
-ℓ, (- ℓ + 1),… 0,… (+ ℓ -1), + ℓ.
Esempio
Se n = 2, sappiamo che ℓ = 0 e ℓ = 1, allora m ℓ assume i seguenti valori:
-Per ℓ = 0: m ℓ = 0.
-Per ℓ = 1: m ℓ = -1, m ℓ = 0, m ℓ = +1
L'orbitale n = 2 ha due sottolivelli, il primo con n = 2, ℓ = 0 e m ℓ = 0. Allora abbiamo il secondo sottolivello: n = 2, ℓ = 1, con 3 orbitali:
- n = 2, ℓ = 1, m ℓ = -1
- n = 2, ℓ = 1, m ℓ = 0
- n = 2, ℓ = 1, m ℓ = +1
I tre orbitali hanno la stessa energia ma un diverso orientamento spaziale.
Spin numero quantico mS
Risolvendo l'equazione di Schrödinger in tre dimensioni, emergono i numeri già descritti. Tuttavia, nell'idrogeno si osserva una struttura ancora più fine che questi numeri non sono sufficienti per spiegare.
Per questo motivo, nel 1921 un altro fisico, Wolfgang Pauli, propose l'esistenza di un quarto numero: il numero di spin mS, che assume valori di + ½ o -½.
Questo numero descrive una proprietà molto importante dell'elettrone, che è il rotazione, parola che viene dall'inglese rotazione (per accendersi). E lo spin a sua volta è correlato alle proprietà magnetiche dell'atomo.
Un modo per capire lo spin è immaginare che l'elettrone si comporti come un minuscolo dipolo magnetico (un magnete con i poli nord e sud), grazie a una rotazione attorno al proprio asse. La rotazione può essere nella stessa direzione in senso orario o nella direzione opposta.
Sebbene Pauli suggerisse l'esistenza di questo numero, i risultati di un esperimento condotto da Otto Stern e Walter Gerlach nel 1922 lo avevano già anticipato..
Questi scienziati sono riusciti a dividere in due un fascio di atomi d'argento applicando un campo magnetico non uniforme.
Il valore di mS non dipende da n, ℓ e m ℓ. In forma grafica, è rappresentato da una freccia: una freccia in alto indica una svolta in senso orario e una freccia in basso indica una svolta in senso antiorario.
Principio di esclusione di Pauli
Il comportamento degli elettroni nell'atomo è riassunto nel principio di esclusione di Pauli, che afferma che due elettroni in un atomo non possono esistere nello stesso stato quantistico.
Pertanto ogni elettrone deve avere un diverso insieme di numeri quantici n, ℓ, m ℓ e mS.
L'importanza dei numeri quantici e di questo principio sta nella comprensione delle proprietà degli elementi nella tavola periodica: gli elettroni sono organizzati in strati secondo n, quindi in sottostrati secondo ℓ e il resto dei numeri.
Riferimenti
- Alonso, M. 1971. Fondamenti quantistici e statistici. Fondo educativo interamericano.
- Bauer, W. 2011. Fisica per l'ingegneria e le scienze. Volume 1. Mc Graw Hill.
- Chang, R. 2013. Chimica. 11 °. Edizione. Mc Graw Hill Education.
- Eisberg-Resnick. 1989. Fisica quantistica. Limusa - Wiley.
- Giambattista, A. 2010. Fisica. 2 °. Ed. McGraw Hill.
- Rex, A. 2011. Fondamenti di fisica. Pearson.
- Tippens, P. 2011. Fisica: concetti e applicazioni. 7a edizione. Mcgraw hill.


Nessun utente ha ancora commentato questo articolo.