
Struttura, proprietà, usi del nitrato di magnesio (Mg (NO3) 2)

Il nitrato di magnesio è un solido inorganico la cui formula chimica è Mg (NO3)Due. È un composto ionico formato dall'unione di un catione di magnesio MgDue+ e due anioni nitrato NO3-.
Mg (NO3)Due è un solido cristallino bianco. È molto igroscopico, cioè assorbe facilmente l'acqua dall'ambiente. Rimanendo a contatto con l'aria circostante, tende a formare il suo Mg esaidrato (NO3)Due•6HDueO.

Magnesio nitrato esaidrato Mg (NO3)Due•6HDueO ha nella sua struttura cristallina 6 molecole di acqua HDueOppure per ogni molecola di Mg (NO3)Due. Il nitrato di magnesio si trova nelle caverne e nelle miniere sotto forma del minerale nitromagnesite.
Mg (NO3)Due ottenuto commercialmente facendo reagire il magnesio metallico Mg con acido nitrico HNO3.
Ha un'ampia varietà di usi, ad esempio in agricoltura come fertilizzante perché fornisce nutrienti per piante come azoto (N) e magnesio (Mg)..
Viene utilizzato nell'industria pirotecnica o pirotecnica e anche per ottenere acido nitrico concentrato. Utilizzato in analisi chimiche, esperimenti di fisica e studi medici e scientifici.
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Punto di ebollizione
- 3.5 Densità
- 3.6 Solubilità
- 3.7 Effetto del riscaldamento
- 4 Ottenimento
- 4.1 Posizione nella natura
- 5 Usi
- 5.1 In studi recenti
- 5.2 Negli studi sulle malattie
- 6 Riferimenti
Struttura
Il nitrato di magnesio anidro è costituito da un catione di magnesio MgDue+ e due anioni nitrato NO3-.
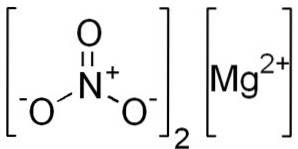
Ione di magnesio MgDue+ possiede una configurazione elettronica: 1sDue, 2sDue 2 P6, 3s0, poiché ha prodotto i due elettroni del guscio più esterno (3s). Questa conformazione è molto stabile.
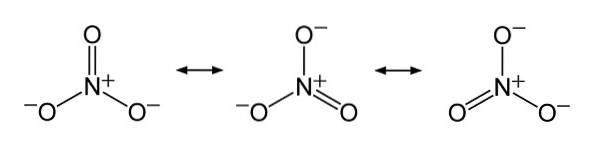
Lo ione NO3- ha una struttura piatta e simmetrica.
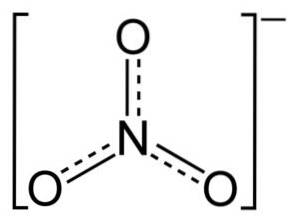
Nella struttura di NO3- la carica negativa è distribuita continuamente tra i tre atomi di ossigeno.
Nomenclatura
-Nitrato di magnesio anidro: Mg (NO3)Due
-Nitrato di magnesio diidrato: Mg (NO3)Due•2HDueO
-Magnesio nitrato esaidrato: Mg (NO3)Due•6HDueO
-Dinitrato di magnesio
Proprietà
Stato fisico
-Mg (NO3)Due anidro: cristalli cubici solidi bianchi.
-Mg (NO3)Due diidrato: solido cristallino bianco.
-Mg (NO3)Due esaidrato: cristalli solidi incolori monoclinici
Peso molecolare
-Mg (NO3)Due anidro: 148,31 g / mol
-Mg (NO3)Due esaidrato: 256,41 g / mol
Punto di fusione
-Mg (NO3)Due esaidrato: 88,9 ºC
Punto di ebollizione
-Mg (NO3)Due esaidrato: non bolle, si decompone a 330 ºC
Densità
-Mg (NO3)Due anidro: 2,32 g / cm3
-Mg (NO3)Due diidrato: 1,456 g / cm3
-Mg (NO3)Due esaidrato: 1.464 g / cm3
Solubilità
Il nitrato di magnesio anidro è molto solubile in acqua: 62,1 g / 100 mL a 0 ºC; 69,5 g / 100 mL a 20 ° C. Inoltre è molto igroscopico, essendo a contatto con l'aria forma rapidamente l'esaidrato.
Mg (NO3)Due diidrato è anche molto solubile in acqua ed etanolo. È igroscopico.
Mg (NO3)Due L'esaidrato è anche molto solubile in acqua. È moderatamente solubile in etanolo. È il più stabile dei tre a contatto con l'aria, cioè dei tre è quello che assorbe meno acqua dall'ambiente.
Effetto riscaldante
Sottoponendo una soluzione acquosa di Mg (NO3)Due Per evaporazione dell'acqua, il sale che cristallizza è l'esaidrato: Mg (NO3)Due•6HDueO. esaidrato significa che nel solido ogni molecola di Mg (NO3)Due è legato a 6 molecole d'acqua.
C'è anche il diidrato Mg (NO3)Due•2HDueOppure, in cui Mg (NO3)Due solido è legato a 2 molecole d'acqua.
Riscaldamento Mg esaidrato (NO3)Due•6HDueOppure non si ottiene il sale anidro, poiché il nitrato di magnesio ha un'elevata affinità per l'acqua.
Per questo motivo, quando riscaldato al di sopra del suo punto di fusione, forma inizialmente un sale misto di nitrato di magnesio e idrossido Mg (NO3)Due•4Mg (OH)Due.
Questo sale misto, al raggiungimento di 400 ºC, si decompone in ossido di magnesio MgO e vengono rilasciati gas di ossido di azoto..
Ottenere
Può essere preparato facendo reagire il carbonato di magnesio MgCO3 con acido nitrico HNO3, emanando anidride carbonica CODue:
MgCO3 + 2 HNO3 → Mg (NO3)Due + CODue↑ + HDueO
Può essere ottenuto anche con idrossido di magnesio Mg (OH)Due e acido nitrico:
Mg (OH)Due + 2 HNO3 → Mg (NO3)Due + 2 hDueO
Commercialmente si ottiene in diversi modi:
1- Reazione del magnesio metallico Mg con acido nitrico HNO3.
2- Facendo reagire l'ossido di magnesio MgO con acido nitrico HNO3.
3- Legante idrossido di magnesio Mg (OH)Due e nitrato di ammonio NH4NON3, formando il nitrato di magnesio con l'evoluzione dell'ammoniaca NH3.
Posizione nella natura
Mg (NO3)Due l'esaidrato si trova naturalmente nelle miniere e nelle grotte o caverne sotto forma del minerale nitromagnesite.
Questo minerale è presente quando il guano entra in contatto con rocce ricche di magnesio. Il guano è il materiale derivante dagli escrementi di uccelli marini e foche in ambienti molto secchi..
Applicazioni
Mg (NO3)Due esaidrato è utilizzato nell'industria ceramica, chimica e agricola.
Questo composto è un fertilizzante perché fornisce azoto (N), che è uno dei tre elementi base richiesti dalle piante, e magnesio (Mg), che è un componente secondario importante anche per le piante..
In questo modo viene utilizzato con altri ingredienti nelle serre e nella coltivazione idroponica. Quest'ultimo consiste nel coltivare le piante in una soluzione acquosa con sali fertilizzanti al posto del terreno.

Viene anche utilizzato come catalizzatore nell'ottenimento di composti petrolchimici. Permette di regolare la viscosità in alcuni processi. Il nitrato di magnesio anidro viene utilizzato nella pirotecnica, cioè per la fabbricazione di fuochi d'artificio.

Il nitrato di magnesio anidro è un agente disidratante. Viene utilizzato, ad esempio, per ottenere acido nitrico concentrato, in quanto elimina l'acqua e concentra i vapori acidi fino al 90-95% di HNO3.

Viene anche utilizzato per rivestire il nitrato di ammonio e consentire la formazione di perle di questo materiale compresso..
È utile nella formulazione di inchiostri, toner (polvere nera utilizzata negli impianti fotocopiatrici) e prodotti coloranti. Serve come standard di magnesio nella chimica analitica.
Il sale di nitrato di magnesio e cerio Mg (NO3)Due•Cipiglio3)3 È interessante per esperimenti di fisica a basse temperature, poiché viene utilizzato come refrigerante negli esperimenti di smagnetizzazione adiabatica (senza trasferimento di calore).
Questo sale di magnesio e cerio è stato utilizzato per stabilire livelli di temperatura estremamente bassi sulla scala Kelvin (vicini allo zero assoluto)..
In studi recenti
Diversi ricercatori hanno utilizzato Mg (NO3)Due in composizioni con polimeri sintetici e naturali per aumentare la conduttività nelle batterie agli ioni di magnesio.
È stato anche studiato nella costruzione di supercondensatori per l'accumulo di energia ad alta potenza.
Negli studi sulle malattie
Il nitrato di magnesio è stato somministrato a ratti da laboratorio con ipertensione arteriosa (alta pressione) e si è scoperto che abbassa efficacemente la pressione sanguigna e attenua o attenua gli effetti delle complicanze di questa malattia..
Ha anche mostrato effetti protettivi contro i disturbi neurologici (disturbo neuronale) e contro la morte nei ratti durante i processi di ostruzione dell'arteria carotide..
Riferimenti
- Qian, M. et al. (2018). Carboni porosi a pochi strati ad alta capacità dalla combustione Pechini di gel di nitrato di magnesio. Interfacce ACS Appl Mater 2018, 10 (1): 381-388. Recupero da ncbi.nlm.nih.gov.
- Manjuladevi, R. et al. (2018). Uno studio sulla miscela di elettroliti polimerici a base di poli (alcol vinilico) -poli (acrilonitrile) con nitrato di magnesio per batterie al magnesio. Ionics (2018) 24: 3493. Recuperato da link.springer.com.
- Kiruthika, S. et al. (2019). Elettrolita biopolimero ecologico, pectina con sale di nitrato di magnesio, per applicazione in dispositivi elettrochimici. J Solid State Electrochem (2019) 23: 2181. Recupero da link.springer.com.
- Vilskerts R. et al. (2014). Il nitrato di magnesio attenua l'aumento della pressione sanguigna nei ratti SHR. Magnes Res 2014, 27 (1): 16-24. Recupero da ncbi.nlm.nih.gov.
- Kuzenkov V.S. e Krushinskii A.L. (2014). Effetto protettivo del nitrato di magnesio contro i disturbi neurologici provocati dall'ischemia cerebrale nei ratti. Bull Exp Biol Med 2014, 157 (6): 721-3. Recupero da ncbi.nlm.nih.gov.
- Ropp, R.C. (2013). Composti alcalino terrosi del gruppo 15 (N, P, As, Sb e Bi). Nitrato di magnesio. In Encyclopedia of the Alkaline Earth Compounds. Recupero da sciencedirect.com.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Volume 1. Quarta edizione. John Wiley & Sons.
- NOI. Biblioteca nazionale di medicina. (2019). Nitrato di magnesio. Estratto da: pubchem.ncbi.nlm.nih.gov.


Nessun utente ha ancora commentato questo articolo.