
Concentrazione molare, unità, calcolo, esercizi
Il molarità è la concentrazione di una soluzione espressa in moli di soluto per litro di soluzione. È abbreviato in M ed esprime una relazione tra la massa del soluto e il volume della soluzione (m / v); sebbene tradizionalmente questa relazione sia espressa come peso a volume.
Una mole è il numero di atomi o molecole contenute nel peso atomico o molecolare; È espresso in grammi / mole. Una mole è uguale a 6,02 · 102. 3 atomi o molecole, noto come numero di Avogadro.
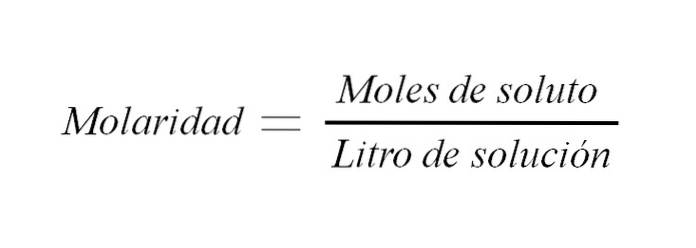
Esistono altri modi per esprimere la relazione tra la massa di un soluto e il volume, tra cui: la relazione percentuale tra la massa del soluto e il volume della soluzione e la normalità. Quest'ultimo è espresso come il numero di equivalenti di un soluto per litro di soluzione.
Nel frattempo, la molalità, che è definita come il numero di moli per chilogrammo di solvente, solitamente acqua, esprime una relazione tra la massa del soluto e la massa del solvente (m / m)..
La forma di espressione della concentrazione di una soluzione in parti per milione (ppm), esprime una relazione tra una parte del soluto e un milione di parti della soluzione, essendo generalmente utilizzata per esprimere una relazione massa-massa (m / m) . Ma puoi esprimere una relazione massa-volume (m / v).
La concentrazione molare, oltre ad essere espressa in moli per litro, può essere espressa in millimoli / litro (soluzione millimolare); micromoli / litro (soluzione micromolare); eccetera.
I problemi di molarità possono essere risolti utilizzando un metodo analitico e utilizzando la "regola del tre". La scelta di un metodo dipenderà dall'abilità che hai nell'uso di uno dei metodi.
Indice articolo
- 1 concentrazione molare
- 2 unità
- 3 Come calcolare la molarità?
- 4 Passa dalla molarità alla molalità
- 4.1 Primo passo
- 4.2 Seconda fase
- 4.3 Terza fase
- 4.4 Quarta fase
- 4.5 Quinto passaggio
- 4.6 Esempio numerico
- 5 Problemi risolti
- 5.1 Problema 1
- 5.2 Problema 2
- 5.3 Problema 3
- 5.4 Problema 4
- 5.5 Problema 5
- 6 Riferimenti
Concentrazione molare
È usato per esprimere la concentrazione di un soluto in un dato volume di soluzione.
M = n / V (1)
Dove M è uguale alla molarità, n è il numero di moli e V è il volume della soluzione. Quindi, la molarità di una soluzione è il numero di moli di soluto per volume di soluzione espresso in litri.
D'altra parte il numero di moli è
n = m / PM (2)
Dove m è la massa del soluto disciolto e PM la sua massa molare.
Sostituendo (2) in (1):
M = (m / PM) / V
Unità
L'unità nel Sistema Internazionale per la concentrazione molare è mol / m3. Ciò corrisponde a una soluzione millimolare, perché l'em3 è uguale a 1.000 litri. Nei rami della chimica e della biologia, la concentrazione molare è solitamente espressa come moli / L. Questa unità è espressa con la M (lettera maiuscola).
Una soluzione di una mole / L è equivalente a una soluzione M; una soluzione di 10-3 moli / L, è uguale a 1 mM (millimolare); e una soluzione di 10-6 moli / L, uguale a 1µM (micromolare).
Come calcolare la molarità?
È conveniente usare le espressioni sopra indicate, perché questo assicura che il risultato dell'applicazione della formula darà in moli / litri, che è la definizione di concentrazione molare.
Quindi, per calcolare la molarità di una soluzione, è necessario esprimere la concentrazione del soluto in g / L. Quindi trovare il peso molecolare del soluto (g / mol) e trovare il rapporto tra la concentrazione e il peso molecolare. Il risultato ottenuto è la molarità espressa in moli / litro.
Passa dalla molarità alla molalità
Un'informazione necessaria per passare dalla molarità alla molalità è conoscere la densità della soluzione. Ciò consente di conoscere la massa della soluzione, requisito essenziale per il calcolo della molalità..
Primo passo
Per prima cosa devi passare dalla concentrazione molare a grammi / litro. Per fare ciò, è sufficiente moltiplicare la molarità della soluzione per il peso molecolare del soluto..
Grammi / litro di soluto = molarità (moli / litro) · peso molecolare del soluto (grammi / mole).
Ciò consente di ottenere la massa del soluto in 1 L di soluzione.
Secondo passo
Quindi è necessario calcolare la massa della soluzione. Per questo, viene utilizzata la densità di esso. Di solito la densità è espressa in grammi / centimetro cubo o millilitro.
Massa della soluzione (g) = volume della soluzione (mL) densità (g / mL)
Terzo passaggio
Ottenere la massa del solvente. Poiché la massa della soluzione è uguale alla massa del soluto più la massa del solvente, per ottenere la massa di quest'ultimo, è sufficiente sottrarre la massa del soluto (passaggio 1) dalla massa della soluzione ( passo 2)..
Quarto passo
Infine, la massa del soluto (g) della soluzione deve essere trasferita alla massa del soluto che corrisponde a 1.000 go 1 kg di solvente. Per fare ciò, sarebbe sufficiente eseguire una semplice regola del tre o un'altra operazione matematica equivalente.
Quinto passo
Dividere g di soluto / 1000 g di solvente per il peso molecolare del soluto (g / mol) per ottenere la molalità della soluzione.
Esempio numerico
Una soluzione di glucosio 3 M (peso molecolare 180 g / mol) ha una densità di 1,15 g / mL. Calcola la molalità di questa soluzione.
Calcoliamo prima i grammi di glucosio disciolti in un litro di soluzione:
g / L = 3 moli / L 180 g / mol
= 540 g / L
Successivamente, calcoliamo la massa della soluzione dalla sua densità:
g di soluzione (massa) = 1.000 mL 1,15 g / mL
= 1.150 g
La massa di solvente è data dalla differenza:
Massa del solvente = massa della soluzione - massa del soluto
= 1.150 g - 540 g
= 610 g
Ma 610 g non sono 1000 g di solvente come stabilito dalla definizione di molalità. Occorre quindi calcolare quanti grammi di glucosio vengono sciolti in 1000 g di solvente:
Massa del soluto = 540 g di soluto (1.000 g di solvente / 610 g di solvente)
= 885,25 g
E infine la molalità viene calcolata restituendo i grammi in moli:
Molalità = (885,25 g di soluto / 180 g / mol)
= 4,92 moli di soluto / kg di solvente
= 4,92 m
Problemi risolti
Problema 1
Quanto solfato rameico ci vorrà per preparare 500 mL di una soluzione 0,4 M? Esprimi il risultato in grammi. Peso molecolare del solfato rameico (CuSO4): 160 g / mol.
Per prima cosa determiniamo le talpe che devono essere sciolte in tale soluzione:
M = n / V
n = M V
n = (0,4 mol / L) 0,5 L
= 0,2 moli
Conoscendo quindi il numero di moli di solfato rameico se ne ricava la massa
n = m / PM
m = peso nmolecolare
m = 0,2 mol 160 g / mol
= 32 g di CuSO4
Cioè, 32 grammi di questo sale devono essere sciolti in 500 ml di solvente.
Problema 2
Quale volume di soluzione è necessario in modo che quando 0,4 moli di soluto si dissolvono, abbia una concentrazione di 0,25 M.?
Il volume della soluzione è ottenuto dal concetto di molarità
M = n / V
V = n / M
V = 0,4 moli / (0,25 moli / L)
= 1,6 L
Significa che la soluzione deve avere un volume di 1,6 litri per ottenere una tale concentrazione di 0,25 M..
Problema 3
Una massa di 8 g di idrossido di sodio (NaOH) viene sciolta in 60 g di una soluzione che ha una densità di 1,6 g / mL. Quale sarà la molarità della soluzione? Peso molecolare dell'idrossido di sodio: 40 g / mol.
Le moli di NaOH devono essere prima calcolate:
n = m / PM
= 8 g di idrossido di sodio / (40 g / mol)
= 0,2 moli
Ora procediamo a calcolare il volume della soluzione:
m = V d
v = 60 g / (1,6 g / mL)
v = 37,5 mL
Per ottenere la molarità, il volume della soluzione in litri deve essere posizionato:
V = 37,5 ml 10-3 L / mL
= 0,0375 L
M = 0,2 moli / 0,0375 L
5,33 moli / L
5.33 M
Problema 4
Calcola la molarità di una soluzione di acido cloridrico (HCl) con una densità di 1,25 g / mL e una concentrazione del 35%, massa / massa espressa. Peso molecolare dell'acido cloridrico: 36,5 g / mol.
Determina la massa dell'acido cloridrico al 35%
m = V d
m = 1.000 mL 1,25 g / mL
= 1.250 g
Ma non tutto è HCl, c'è anche l'acqua:
massa HCl = 1.250 g (35/100)
= 437,5 g
Il che equivale a dire che in un litro di soluzione di HCl al 35% ci sono 437,5 grammi di HCl.
Quindi, vengono calcolate le moli di HCl, per determinare immediatamente la molarità:
n = m / PM
n = (437,5 g / L) / (36,5 g / mol)
= 11,98 moli / L
Molarità = 11,98 M.
Problema 5
Calcola la molarità di una soluzione contenente 5 g di NaCl in 2 L di soluzione. Peso molecolare del cloruro di sodio: 58,5 g / mol.
Le moli / L di NaCl possono essere ottenute in un unico passaggio:
molarità = (5 g NaCl / 2 L soluzione) x (1 mol NaCl / 58,5 g NaCl)
= 0,043 mol / L
Molarità = 0,043 M.
Un'altra procedura potrebbe essere:
g / L NaCl = 5 g / 2 L
= 2,5 g / L
moli / L = (2,5 g / L) / (58,5 g / mol)
= 0,043 mol / L
= 0,043 M
Riferimenti
- Rodríguez, M. (2007). Chimica. Fondazione editoriale salesiana
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Wikipedia. (2019). Molarità Estratto da: es.wikipedia.org
- Atarés Huerta. (s.f.). Molarità e molalità. [PDF]. Estratto da: riunet.upv.es
- Softchools. (2019). Formula molare. Estratto da: softschools.com



Nessun utente ha ancora commentato questo articolo.