
Menisco (chimica) in cosa consiste e tipi
Il menisco è la curvatura della superficie di un liquido. È anche la superficie libera di un liquido all'interfaccia liquido-aria. I liquidi sono caratterizzati dall'avere un volume fisso, essendo scarsamente comprimibili.
Tuttavia, la forma dei liquidi varia adottando la forma del contenitore che li contiene. Questa caratteristica è dovuta al movimento casuale delle molecole che le formano..

I liquidi hanno la capacità di scorrere, ad alta densità e diffondersi rapidamente in altri liquidi con i quali sono miscibili. Occupano per gravità la zona più bassa del contenitore, lasciando una superficie libera non totalmente piana nella parte superiore. In alcune circostanze possono assumere forme speciali come gocce, bolle e bolle..
Le proprietà dei liquidi come punto di fusione, tensione di vapore, viscosità e calore di vaporizzazione dipendono dall'intensità delle forze intermolecolari che conferiscono coesione ai liquidi..
Tuttavia, i liquidi interagiscono anche con il contenitore attraverso forze di adesione. Il menisco nasce quindi da questi fenomeni fisici: la differenza tra le forze di coesione tra le particelle del liquido e quelle di adesione che permette loro di bagnare le pareti..
Indice articolo
- 1 Qual è il menisco?
- 1.1 Forze di coesione
- 1.2 Forze di adesione
- 2 tipi di menischi
- 2.1 Concavo
- 2.2 Convesso
- 3 Tensione superficiale
- 4 Capillarità
- 5 Riferimenti
Qual è il menisco?
Come appena spiegato, il menisco è il risultato di diversi fenomeni fisici, tra i quali si può citare anche la tensione superficiale del liquido..
Forze di coesione
Le forze di coesione è il termine fisico che spiega le interazioni intermolecolari all'interno del liquido. Nel caso dell'acqua, le forze di coesione sono dovute all'interazione dipolo-dipolo e ai legami idrogeno.
La molecola d'acqua è di natura bipolare. Ciò è dovuto al fatto che l'ossigeno nella molecola è elettronegativo in quanto ha una maggiore avidità per gli elettroni rispetto agli idrogeni, il che determina che l'ossigeno è lasciato con una carica negativa e gli idrogeni sono caricati positivamente..
Esiste un'attrazione elettrostatica tra la carica negativa di una molecola d'acqua, situata sull'ossigeno, e la carica positiva di un'altra molecola d'acqua, situata sugli idrogeni..
Questa interazione è quella che è nota come interazione o forza dipolo-dipolo, che contribuisce alla coesione del liquido..
Forze di adesione
D'altra parte, le molecole d'acqua possono interagire con le pareti di vetro, caricando parzialmente gli atomi di idrogeno delle molecole d'acqua che si legano fortemente agli atomi di ossigeno sulla superficie del vetro..
Ciò costituisce la forza di adesione tra il liquido e la parete rigida; colloquialmente si dice che il liquido bagna il muro.
Quando una soluzione di silicone viene posizionata sulla superficie del vetro, l'acqua non impregna completamente il vetro, ma sul vetro si formano delle goccioline che possono essere facilmente rimosse. Pertanto, è indicato che con questo trattamento la forza di adesione tra acqua e vetro viene ridotta..
Un caso molto simile si verifica quando le mani sono unte e quando vengono lavate in acqua, si possono vedere gocce molto definite sulla pelle invece di una pelle umida.
Tipi di menischi
Esistono due tipi di menischi: il concavo e il convesso. Nell'immagine, il concavo è A e il convesso è B. Le linee tratteggiate indicano il livello corretto durante la lettura di una misurazione del volume.
Concavo
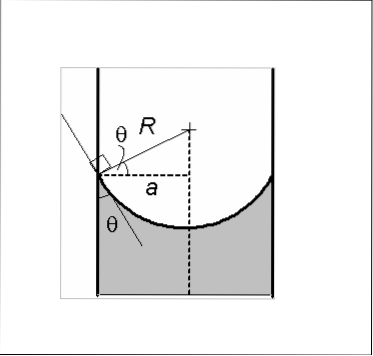
Il menisco concavo si caratterizza perché l'angolo di contatto θ formato dalla parete di vetro con una linea tangente al menisco e, che viene introdotto nel liquido, ha un valore inferiore a 90º. Se una quantità di liquido viene posta sul vetro, tende a spargersi sulla superficie del vetro..
La presenza di un menisco concavo mostra che le forze di coesione all'interno del liquido sono inferiori alla forza di adesione della parete di vetro liquido.
Pertanto, il liquido bagna o bagna la parete di vetro, trattenendo una quantità di liquido e conferendo al menisco una forma concava. L'acqua è un esempio di un fluido che forma i menischi concavi.
Convesso
Nel caso del menisco convesso, l'angolo di contatto θ ha un valore maggiore di 90º. Il mercurio è un esempio di un liquido che forma i menischi convessi. Quando una goccia di mercurio viene posta su una superficie di vetro, l'angolo di contatto θ ha un valore di 140º.
L'osservazione di un menisco convesso indica che le forze di coesione del liquido sono maggiori della forza di adesione tra il liquido e la parete di vetro. Si dice che il liquido non bagna il vetro.
Le forze superficiali di coesione (liquido-liquido) e di adesione (liquido-solido) sono responsabili di molti fenomeni di interesse biologico; questo è il caso della tensione superficiale e della capillarità.
Tensione superficiale
La tensione superficiale è una forza di attrazione netta che viene esercitata sulle molecole del liquido che si trova in superficie e che tende a introdurle nel liquido..
Pertanto, la tensione superficiale tende a fondere il liquido ea conferirgli menischi più concavi; O in altre parole: questa forza tende a rimuovere la superficie del liquido dalla parete di vetro.
La tensione superficiale tende a diminuire all'aumentare della temperatura, ad esempio: la tensione superficiale dell'acqua è pari a 0,076 N / ma 0 ºC e 0,059 N / ma 100 ºC.
Nel frattempo, la tensione superficiale del mercurio a 20 ºC è 0,465 N / m. Questo spiegherebbe perché il mercurio forma menischi convessi.
Capillarità
Se l'angolo di contatto θ è inferiore a 90º e il liquido bagna la parete di vetro, il liquido all'interno dei capillari di vetro può raggiungere una condizione di equilibrio.
Il peso della colonna di liquido è compensato dalla componente verticale della forza di coesione dovuta alla tensione superficiale. La forza di adesione non interviene perché sono perpendicolari alla superficie del tubo.
Questa legge non spiega come l'acqua possa salire dalle radici alle foglie attraverso i vasi dello xilema..
In realtà ci sono altri fattori che intervengono in tal senso, ad esempio: l'acqua evaporando nelle foglie permette di aspirare le molecole d'acqua presenti nella parte superiore dei capillari.
Ciò consente ad altre molecole dal fondo dei capillari di salire per prendere il posto delle molecole di acqua evaporata..
Riferimenti
- Ganong, W. F. (2002). Fisiologia medica. 2002. 19a edizione. Redazione del manuale moderno.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Helmenstine, Anne Marie, Ph.D. (4 agosto 2018). Come leggere un menisco in chimica. Estratto da: thoughtco.com
- Wikipedia. (2018). Menisco (liquido). Estratto da: en.wikipedia.org
- Friedl S. (2018). Cos'è un menisco? Studia. Estratto da: study.com
- Tensione superficiale. Estratto da: chem.purdue.edu



Nessun utente ha ancora commentato questo articolo.