
Definizione di massa atomica, tipi, come calcolarla, esempi

Il massa atomica è la quantità di materia presente in un atomo, che può essere espressa in unità fisiche ordinarie o in unità di massa atomica (uma o u). Un atomo è vuoto nella maggior parte della sua struttura; elettroni che sono diffusi in regioni chiamate orbitali, dove c'è una certa probabilità di trovarli, e il loro nucleo.
Protoni e neutroni si trovano nel nucleo dell'atomo; le prime con cariche positive, mentre le seconde con cariche neutre. Queste due particelle subatomiche hanno una massa molto maggiore di quella dell'elettrone; Pertanto, la massa di un atomo è governata dal suo nucleo e non dal vuoto né dagli elettroni.
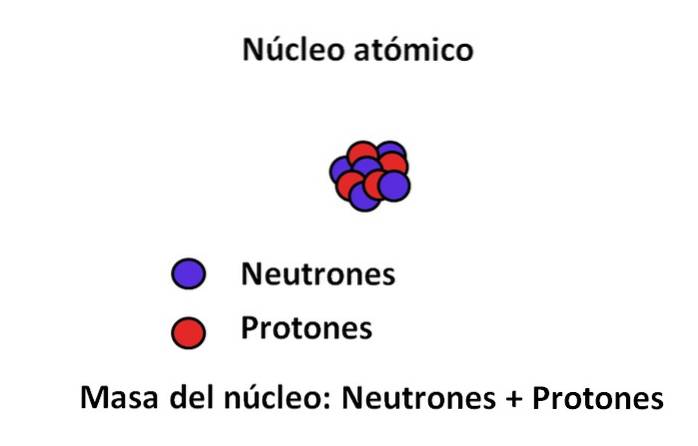
La massa di un elettrone è di circa 9,110-31 kg, mentre quella del protone 1,67 · 10-27 kg, il rapporto di massa essendo 1.800; cioè, un protone "pesa" 1.800 volte di più di un elettrone. Allo stesso modo, lo stesso accade con le masse del neutrone e dell'elettrone. Ecco perché il contributo di massa dell'elettrone per scopi ordinari è considerato trascurabile..
Per questo motivo si presume spesso che la massa dell'atomo, o massa atomica, dipenda solo dalla massa del nucleo; che, a sua volta, consiste nella somma della materia dei neutroni e dei protoni. Da questo ragionamento emergono due concetti: numero di massa e massa atomica, entrambi strettamente correlati..
Essendo così tanto "vuoto" negli atomi, e poiché la loro massa è quasi interamente una funzione del nucleo, c'è da aspettarsi che quest'ultimo sia straordinariamente denso..
Se rimuoviamo detto vuoto da qualsiasi corpo o oggetto, le sue dimensioni si contrarrebbero drasticamente. Inoltre, se potessimo costruire un piccolo oggetto basato su nuclei atomici (senza elettroni), allora avrebbe una massa di milioni di tonnellate..
D'altra parte, le masse atomiche aiutano a distinguere diversi atomi dello stesso elemento; questi sono gli isotopi. Poiché vi sono isotopi più abbondanti di altri, è necessario stimare una media delle masse degli atomi per un dato elemento; media che può variare da pianeta a pianeta, o da una regione spaziale all'altra.
Indice articolo
- 1 Definizione e concetto
- 1.1 Unità di massa atomica
- 1.2 Equivalenza in grammi
- 2 Massa atomica media
- 2.1 Esempio
- 3 Massa atomica assoluta
- 4 Massa atomica relativa
- 5 Come calcolare la massa atomica
- 6 esempi
- 6.1 Carbonio
- 6.2 Sodio
- 6.3 Ossigeno
- 6.4 Azoto
- 6.5 Cloro
- 6.6 Disprosio
- 7 Riferimenti
Definizione e concetto
Per definizione, la massa atomica è la somma delle masse dei suoi protoni e neutroni espressa con uma o u. Il numero risultante (a volte chiamato anche un numero di massa) è posto adimensionale nell'angolo in alto a sinistra nella notazione usata per i nuclidi. Ad esempio, per l'elemento quindiciX la sua massa atomica è 15uma o 15u.
La massa atomica non può dire molto sulla vera identità di questo elemento X. Viene invece utilizzato il numero atomico, che corrisponde ai protoni nel nucleo di X. Se questo numero è 7, la differenza (15-7) sarà uguale a 8; cioè, X ha 7 protoni e 8 neutroni, la cui somma è 15.
Tornando all'immagine, il nucleo ha 5 neutroni e 4 protoni, quindi il suo numero di massa è 9; ea sua volta 9 amu è la massa del suo atomo. Avendo 4 protoni e consultando la tavola periodica, si può vedere che questo nucleo corrisponde a quello dell'elemento berillio, Be (o 9Essere).
Unità di massa atomica
Gli atomi sono troppo piccoli per poter misurare le loro masse con metodi convenzionali o bilance ordinarie. È per questo motivo che è stato inventato uma, uo Da (daltonico). Queste unità ideate per gli atomi ti permettono di avere un'idea di quanto siano massicci gli atomi di un elemento in relazione tra loro..
Ma cosa rappresenta esattamente un amu? Deve esserci un riferimento che consenta di stabilire relazioni di massa. Per questo, l'atomo è stato utilizzato come riferimento 12C, che è l'isotopo più abbondante e stabile per il carbonio. Avendo 6 protoni (il suo numero atomico Z) e 6 neutroni, la sua massa atomica è quindi 12.
Si presume che protoni e neutroni abbiano le stesse masse, in modo che ciascuno contribuisca con 1 amu. L'unità di massa atomica è quindi definita come un dodicesimo (1/12) della massa di un atomo di carbonio-12; questa è la massa di un protone o di un neutrone.
Equivalenza in grammi
E ora sorge la seguente domanda: quanti grammi è uguale a 1 amu? Poiché all'inizio non c'erano tecniche sufficientemente avanzate per misurarlo, i chimici dovettero accontentarsi di esprimere tutte le masse con amu; tuttavia, questo era un vantaggio e non uno svantaggio.
Perché? Poiché le particelle subatomiche sono così piccole, la loro massa, espressa in grammi, deve essere stata altrettanto piccola. In effetti, 1 amu equivale a 1,6605 · 10-24 grammi. Inoltre, con l'uso del concetto di mole, non era un problema lavorare le masse degli elementi e dei loro isotopi con amu sapendo che tali unità potevano essere modificate in g / mol.
Ad esempio, tornando a quindiciX e 9Be, abbiamo che le loro masse atomiche sono rispettivamente di 15 amu e 9 amu. Poiché queste unità sono così piccole e non dicono direttamente quanta materia si deve "pesare" per manipolarle, vengono trasformate nelle rispettive masse molari: 15 g / mol e 9 g / mol (introducendo i concetti di moli e numero di Avogadro ).
Massa atomica media
Non tutti gli atomi dello stesso elemento hanno la stessa massa. Ciò significa che devono avere più particelle subatomiche nel nucleo. Essendo lo stesso elemento, il numero atomico o il numero di protoni deve rimanere costante; quindi, c'è solo variazione nella quantità di neutroni che possiedono.
Così appare dalla definizione di isotopi: atomi dello stesso elemento ma con masse atomiche differenti. Ad esempio, il berillio è costituito quasi interamente dall'isotopo 9Be, con tracce di 10Essere. Tuttavia, questo esempio non è molto utile per comprendere il concetto di massa atomica media; abbiamo bisogno di uno con più isotopi.
Esempio
Supponiamo che l'elemento esista 88J, essendo questo l'isotopo principale di J con un'abbondanza del 60%. J ha anche altri due isotopi: 86J, con un'abbondanza del 20%, e 90J, con un'abbondanza anche del 20%. Ciò significa che su 100 atomi J che raccogliamo sulla Terra, 60 lo sono 88J e i restanti 40 una miscela di 86J e 90J.
Ciascuno dei tre isotopi di J ha la sua massa atomica; cioè la loro somma di neutroni e protoni. Tuttavia, queste masse devono essere mediate per avere una massa atomica per J a portata di mano; qui sulla Terra, poiché potrebbero esserci altre regioni dell'Universo in cui l'abbondanza di 86J è del 56% e non del 60%.
Per calcolare la massa atomica media di J si deve ottenere la media ponderata delle masse dei suoi isotopi; cioè tenendo conto della percentuale di abbondanza per ciascuno di essi. Quindi abbiamo:
Massa media (J) = (86 amu) (0,60) + (88 amu) (0,20) + (90 amu) (0,20)
= 87,2 amu
Cioè, la massa atomica media (nota anche come peso atomico) di J è 87,2 amu. Nel frattempo, la sua massa molare è 87,2 g / mol. Si noti che 87,2 è più vicino a 88 che a 86 ed è anche distante da 90.
Massa atomica assoluta
La massa atomica assoluta è la massa atomica espressa in grammi. Partendo dall'esempio dell'ipotetico elemento J, possiamo calcolare la sua massa atomica assoluta (quella della media) sapendo che ogni amu è equivalente a 1.6605 · 10-24 grammi:
Massa atomica assoluta (J) = 87,2 amu * (1,6605 · 10-24 g / am)
= 1.447956 10-22 g / atomo J
Ciò significa che in media gli atomi J hanno una massa assoluta di 1.447956 · 10-22 g.
Massa atomica relativa
La massa atomica relativa è numericamente identica alla massa atomica media per un dato elemento; Tuttavia, a differenza del secondo, il primo manca di unità. Pertanto, è adimensionale. Ad esempio, la massa atomica media del berillio è 9,012182 u; mentre la sua massa atomica relativa è semplicemente 9.012182.
Questo è il motivo per cui questi concetti a volte vengono interpretati erroneamente come sinonimi, poiché sono molto simili e le differenze tra loro sono sottili. Ma a cosa sono relative queste masse? Rispetto a un dodicesimo della massa del 12C.
Pertanto, un elemento con una massa atomica relativa di 77 significa che ha una massa 77 volte maggiore di 1/12 della 12C.
Coloro che hanno esaminato gli elementi nella tavola periodica vedranno che le loro masse sono relativamente espresse. Non hanno unità di amu, ed è interpretato come: il ferro ha una massa atomica di 55.846, il che significa che è 55.846 volte più massa della massa di 1/12 del 12C, e che può anche essere espresso come 55,846 amu o 55,846 g / mol.
Come calcolare la massa atomica
Matematicamente, è stato fornito un esempio di come calcolarlo con l'esempio dell'elemento J. In termini generali, deve essere applicata la formula della media ponderata, che sarebbe:
P = Σ (massa atomica dell'isotopo) (abbondanza in decimali)
In altre parole, avendo le masse atomiche (neutroni + protoni) di ciascun isotopo (normalmente naturale) per un dato elemento, nonché le rispettive abbondanze terrestri (o qualunque sia la regione considerata), allora si può calcolare detta media ponderata..
E perché non solo la media aritmetica? Ad esempio, la massa atomica media di J è 87,2 amu. Se calcoliamo di nuovo questa massa ma aritmeticamente avremo:
Massa media (J) = (88 amu + 86 amu + 90 amu) / 3
= 88 amu
Nota che c'è una differenza importante tra 88 e 87,2. Questo perché la media aritmetica presuppone che l'abbondanza di tutti gli isotopi sia la stessa; Poiché ci sono tre isotopi di J, ciascuno dovrebbe avere un'abbondanza di 100/3 (33,33%). Ma in realtà non è così: ci sono isotopi molto più abbondanti di altri.
Questo è il motivo per cui viene calcolata la media ponderata, poiché tiene conto dell'abbondanza di un isotopo rispetto a un altro..
Esempi
Carbonio
Per calcolare la massa atomica media del carbonio abbiamo bisogno dei suoi isotopi naturali con le rispettive abbondanze. Nel caso del carbonio questi sono: 12C (98,89%) e 13C (1,11%). Le loro masse atomiche relative sono rispettivamente 12 e 13, che a loro volta sono uguali a 12 amu e 13 amu. Risolvendo:
Massa atomica media (C) = (12 amu) (0,9889) + (13 amu) (0,0111)
= 12,0111 amu
Pertanto, la massa di un atomo di carbonio è in media 12,01 amu. Poiché ci sono tracce di 14C, non ha quasi alcuna influenza su questa media.
Sodio
Tutti gli atomi di sodio terrestri sono costituiti dall'isotopo 2. 3Na, quindi la sua abbondanza è del 100%. Questo è il motivo per cui nei calcoli ordinari si può presumere che la sua massa sia semplicemente 23 amu o 23 g / mol. Tuttavia, la sua massa esatta è 22,98976928 amu.
Ossigeno
I tre isotopi dell'ossigeno con le rispettive abbondanze sono: 16O (99,762%), 17O (0,038%) e 18O (0,2%). Abbiamo tutto per calcolare la sua massa atomica media:
Massa atomica media (O) = (16 amu) (0,99762) + (17 amu) (0,00038) + (18 amu) (0,002)
= 16,00438 amu
Sebbene la sua massa esatta riportata sia in realtà 15,9994 amu.
Azoto
Ripetendo gli stessi passaggi con l'ossigeno abbiamo: 14N (99,634%) e quindiciN (0,366%). Poi:
Massa atomica media (N) = (14 amu) (0,99634) + (15 amu) (0,00366)
= 14,00366 amu
Si noti che la massa riportata per l'azoto è 14,0067 amu, un po 'più alta di quella che abbiamo calcolato.
Cloro
Gli isotopi del cloro con le rispettive abbondanze sono: 35Cl (75,77%) e 37Cl (24,23%). Calcolando la sua massa atomica media abbiamo:
Massa atomica media (Cl) = (35 amu) (0.7577) + (37 amu) (0.2423)
= 35,4846 amu
Molto simile a quello riportato (35.453 amu).
Disprosio
Infine, verrà calcolata la massa media di un elemento con molti isotopi naturali: il disprosio. Questi e con le rispettive abbondanze sono: 156Dy (0,06%), 158Dy (0,10%), 160Dy (2,34%), 161Dy (18,91%), 162Dy (25,51%), 163Dy (24,90%) e 164Dy (28,18%).
Procediamo come negli esempi precedenti per calcolare la massa atomica di questo metallo:
Massa atomica media (Dy) = (156 amu) (0,0006%) + (158 amu) (0,0010) + (160 amu) (0,0234) + (161 amu) (0,1891) + (162 amu) (0,2551) + (163 amu) (0,2490) + (164 amu) (0,2818)
= 162,5691 amu
La massa riportata è 162.500 amu. Si noti che questa media è compresa tra 162 e 163, poiché gli isotopi 156Dy, 158Dy e 160Dy sono pochi abbondanti; mentre quelli che predominano sono 162Dy, 163Dy e 164Dy.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Wikipedia. (2019). Massa atomica. Estratto da: en.wikipedia.org
- Christopher Masi. (s.f.). Atomic Mass. Estratto da: wsc.mass.edu
- Natalie Wolchover. (12 settembre 2017). Come si pesa un atomo? Scienza dal vivo. Estratto da: livescience.com
- Chemistry LibreTexts. (05 giugno 2019). Calcolo delle masse atomiche. Recupero da: chem.libretexts.orgs
- Edward Wichers e H. Steffen Peiser. (15 dicembre 2017). Peso atomico. Encyclopædia Britannica. Estratto da: britannica.com


Nessun utente ha ancora commentato questo articolo.