
Applicazioni della legge di Beer-Lambert ed esercizi risolti
Il Legge di Beer-Lambert (Beer-Bouguer) è quello che mette in relazione l'assorbimento della radiazione elettromagnetica di una o più specie chimiche, con la sua concentrazione e la distanza percorsa dalla luce nelle interazioni particella-fotone. Questa legge riunisce due leggi in una.
La legge di Bouguer (sebbene il riconoscimento sia ricaduto maggiormente su Heinrich Lambert), stabilisce che un campione assorbirà più radiazioni quando le dimensioni del mezzo o materiale assorbente sono maggiori; in particolare, il suo spessore, che è la distanza l che la luce viaggia quando entra e esce.
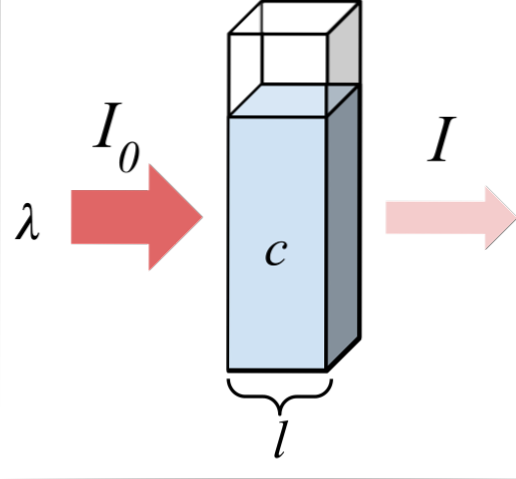
L'immagine in alto mostra l'assorbimento della radiazione monocromatica; cioè costituito da un'unica lunghezza d'onda, λ. Il mezzo assorbente si trova all'interno di una cella ottica, il cui spessore è l, e contiene specie chimiche con una concentrazione c.
Il fascio luminoso ha un'intensità iniziale e finale, indicata dai simboli I0 e io, rispettivamente. Si noti che dopo aver interagito con il mezzo assorbente, I è inferiore a I0, il che mostra che c'era assorbimento di radiazioni. Più sono vecchi c Y l, più piccolo sarò io rispetto a me0; cioè, ci sarà più assorbimento e meno trasmissione.
Indice articolo
- 1 Qual è la legge di Beer-Lambert?
- 1.1 Assorbanza e trasmittanza
- 1.2 Grafica
- 2 Applicazioni
- 3 esercizi risolti
- 3.1 Esercizio 1
- 3.2 Esercizio 2
- 4 Riferimenti
Qual è la legge di Beer-Lambert?
L'immagine sopra racchiude perfettamente questa legge. L'assorbimento della radiazione in un campione aumenta o diminuisce in modo esponenziale in funzione di c o l. Per comprendere appieno e facilmente la legge, è necessario ignorarne gli aspetti matematici.
Come appena accennato, io0 e io sono le intensità del fascio di luce monocromatico prima e dopo la luce, rispettivamente. Alcuni testi preferiscono utilizzare i simboli P0 e P, che si riferiscono all'energia della radiazione e non alla sua intensità. Qui, la spiegazione continuerà usando le intensità.
Per linearizzare l'equazione di questa legge, è necessario applicare il logaritmo, generalmente la base 10:
Log (I0/ I) = εlc
Il termine (I.0/ I) indica di quanto diminuisce l'intensità del prodotto radiante di assorbimento. La legge di Lambert considera solo l (εl), mentre la legge di Beer ignora l, ma posti c invece (εc). L'equazione superiore è l'unione di entrambe le leggi, e quindi è l'espressione matematica generale per la legge di Beer-Lambert.
Assorbanza e trasmittanza
L'assorbanza è definita dal termine Log (I.0/ IO). Pertanto, l'equazione è espressa come segue:
A = εlc
Dove ε è il coefficiente di estinzione o assorbimento molare, che è una costante a una data lunghezza d'onda.
Si noti che se lo spessore del mezzo assorbente viene mantenuto costante, come ε, l'assorbanza A dipenderà solo dalla concentrazione c, di specie assorbenti. Inoltre, è un'equazione lineare, y = mx, dove Y è A, e X è c.
All'aumentare dell'assorbanza, la trasmittanza diminuisce; cioè, quanta radiazione riesce a essere trasmessa dopo l'assorbimento. Sono quindi inversi. si Io0/ I indica il grado di assorbimento, I / I0 è uguale a trasmittanza. Sapendo questo:
Io / io0 = T
(IO0/ I) = 1 / T
Log (I0/ I) = Log (1 / T)
Ma Log (I.0/ I) è anche uguale all'assorbanza. Quindi la relazione tra A e T è:
A = Log (1 / T)
E applicando le proprietà dei logaritmi e sapendo che Log1 è uguale a 0:
A = -LogT
Le trasmittanze sono solitamente espresse in percentuale:
% T = I / I0∙ 100
Grafici
Come affermato in precedenza, le equazioni corrispondono a una funzione lineare; quindi, ci si aspetta che quando vengono rappresentati graficamente forniscano una linea.
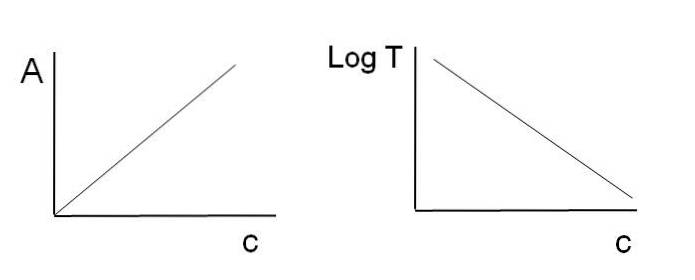
Si noti che a sinistra dell'immagine sopra c'è la linea ottenuta rappresentando graficamente A contro c, ea destra la linea corrispondente al grafico di LogT contro c. Uno ha una pendenza positiva e l'altro negativo; maggiore è l'assorbanza, minore è la trasmittanza.
Grazie a questa linearità è possibile determinare la concentrazione delle specie chimiche assorbenti (cromofori) se si sa quanta radiazione assorbono (A) o quanta radiazione viene trasmessa (LogT). Quando questa linearità non viene osservata, si dice che si trova di fronte a una deviazione, positiva o negativa, della legge di Beer-Lambert.
Applicazioni
In termini generali, alcune delle applicazioni più importanti di questa legge sono menzionate di seguito:
-Se una specie chimica mostra colore, è un candidato esemplare per essere analizzato con tecniche colorimetriche. Si basano sulla legge di Beer-Lambert e consentono di determinare la concentrazione degli analiti in funzione delle assorbanze ottenute con uno spettrofotometro..
-Consente la costruzione di curve di calibrazione, con le quali, tenuto conto dell'effetto matrice del campione, si determina la concentrazione delle specie di interesse.
-È ampiamente utilizzato per analizzare le proteine, poiché diversi amminoacidi hanno assorbimenti significativi nella regione ultravioletta dello spettro elettromagnetico..
-Reazioni chimiche o fenomeni molecolari che comportano un cambiamento di colore possono essere analizzati utilizzando valori di assorbanza a una o più lunghezze d'onda..
-Utilizzando l'analisi multivariata, è possibile analizzare miscele complesse di cromofori. In questo modo è possibile determinare la concentrazione di tutti gli analiti e anche classificare e differenziare le miscele tra loro; ad esempio, escludere se due minerali identici provengono dallo stesso continente o paese specifico.
Esercizi risolti
Esercizio 1
Qual è l'assorbanza di una soluzione che mostra una trasmittanza del 30% a una lunghezza d'onda di 640 nm??
Per risolverlo, basta andare alle definizioni di assorbanza e trasmittanza.
% T = 30
T = (30/100) = 0,3
E sapendo che A = -LogT, il calcolo è semplice:
A = -Log 0,3 = 0,5228
Nota che manca di unità.
Esercizio 2
Se la soluzione dell'esercizio precedente consiste in una specie W la cui concentrazione è 2,30 ∙ 10-4 M, e supponendo che la cella abbia uno spessore di 2 cm: quale dovrebbe essere la sua concentrazione per ottenere una trasmittanza dell'8%??
Potrebbe essere risolto direttamente con questa equazione:
-LogT = εlc
Ma il valore di ε è sconosciuto. Pertanto, deve essere calcolato con i dati precedenti e si presume che rimanga costante su un ampio intervallo di concentrazioni:
ε = -LogT / lc
= (-Log 0,3) / (2 cm x 2,3 ∙ 10-4 M)
= 1136,52 M-1∙ cm-1
E ora, puoi procedere al calcolo con% T = 8:
c = -LogT / εl
= (-Log 0,08) / (1136,52 M-1∙ cm-1 x 2 cm)
= 4,82 ∙ 10-4 M
Quindi, è sufficiente che la specie W raddoppi la sua concentrazione (4,82 / 2,3) per ridurre la sua percentuale di trasmittanza dal 30% all'8%..
Riferimenti
- Day, R. e Underwood, A. (1965). Chimica analitica quantitativa. (quinto ed.). PEARSON Prentice Hall, pagine 469-474.
- Skoog D.A., West D.M. (1986). Analisi strumentale. (seconda ed.). Interamericana., Messico.
- Soderberg T. (18 agosto 2014). La legge Beer-Lambert. Chemistry LibreTexts. Recupero da: chem.libretexts.org
- Clark J. (maggio 2016). La legge Beer-Lambert. Estratto da: chemguide.co.uk
- Analisi colorimetrica: legge di Beer o analisi spettrofotometrica. Estratto da: chem.ucla.edu
- Dr. J.M. Fernandez Alvarez. (s.f.). Chimica analitica: manuale dei problemi risolti. [PDF]. Estratto da: dadun.unav.edu



Nessun utente ha ancora commentato questo articolo.