
Tipi di incretina e loro struttura, funzioni, meccanismo d'azione
Il incretina sono ormoni gastrointestinali che stimolano la secrezione di concentrazioni fisiologiche di insulina. Il termine è attualmente utilizzato per riferirsi a due diversi ormoni intestinali, che hanno nomi tecnici diversi: GIP o "polipeptide insulinotropico glucosio-dipendente" e GLP-1 o "peptide 1 simile al glucagone".
"Incretin" è una parola e un concetto coniato nel 1932 dal fisiologo belga Jean La Barre, che lo introdusse per definire i fattori ormonali intestinali che completavano gli effetti della secretina sulla secrezione pancreatica endocrina..
In altre parole, La Barre ha utilizzato il termine incretina per indicare qualsiasi ormone intestinale che, in condizioni fisiologiche, fosse in grado di stimolare o contribuire alla secrezione di ormoni pancreatici come insulina, glucagone, polipeptide pancreatico (PP) e somatostatina..
Tuttavia, attualmente il termine "incretina" è usato solo per denotare quegli ormoni in grado di stimolare la sintesi di insulina pancreatica glucosio-dipendente, in particolare due peptidi noti come GIP e GLP-1. Tuttavia, l'avvento di nuove tecnologie e studi endocrinologici più approfonditi potrebbero rivelare molti altri peptidi con attività simili..
Indice articolo
- 1 Tipi di incretine e loro struttura
- 2 funzioni
- 3 Meccanismo d'azione
- 3.1 GIP: polipeptide insulinotropico glucosio-dipendente
- 3.2 GLP-1: peptide simile al glucagone 1
- 4 Riferimenti
Tipi di incretine e loro struttura
Tradizionalmente, solo due incretine sono state definite nell'uomo: il polipeptide insulinotropico glucosio-dipendente (GIP) e il peptide 1 simile al glucagone (GLP-1); i due ormoni agiscono in modo additivo stimolando la secrezione di insulina.
Il primo di questi ad essere isolato è stato il polipeptide insulinotropico glucosio-dipendente (GIP). Polipeptide insulinotropico glucosio-dipendente). È un ormone peptidico di circa 42 aminoacidi e appartiene alla famiglia dei peptidi glucagone-secretina.

La seconda incretina scoperta era il peptide 1 simile al glucagone (GLP-1). Peptide-1 simile al glucagone), che è un sottoprodotto del gene che codifica per l'ormone "proglucagone"; parte dell'estremità C-terminale della proteina, per essere più precisi.
Caratteristiche
Inizialmente, le incretine erano definite come fattori derivati dal tratto intestinale che hanno la capacità di abbassare i livelli di glucosio plasmatico attraverso la stimolazione della secrezione di ormoni pancreatici come l'insulina e il glucagone..
Questo concetto è stato mantenuto con l'avvento dei saggi radioimmunologici, dove è stata confermata la comunicazione permanente tra l'intestino e il pancreas endocrino..
La somministrazione orale di glucosio ha dimostrato di essere associata ad aumenti significativi dei livelli di insulina plasmatica, soprattutto rispetto ai risultati ottenuti con glucosio per via endovenosa..
Si ritiene che le incretine siano responsabili della secrezione di quasi il 70% dell'insulina plasmatica dopo somministrazione orale di glucosio, poiché sono ormoni secreti in risposta all'assunzione di nutrienti, che aumenta la secrezione di glucosio-insulina dipendente..
Attualmente sono in corso molti sforzi per quanto riguarda la somministrazione orale o endovenosa di incretine a pazienti con malattie come il diabete mellito di tipo 2 o l'intolleranza al glucosio orale. Questo perché studi hanno dimostrato, seppur in via preliminare, che queste sostanze facilitano la rapida diminuzione dei livelli glicemici dopo l'assunzione di cibo..
Meccanismo di azione
GIP: polipeptide insulinotropico glucosio-dipendente
Questa incretina è prodotta dalle cellule K dell'intestino tenue (nel duodeno e nel digiuno, in particolare) in risposta all'ingestione di grassi o glucosio ed è responsabile dell'aumento della secrezione di insulina stimolata dal glucosio.
L'espressione del gene che codifica per questo fattore ormonale è stata dimostrata nell'uomo e nei roditori sia nello stomaco che nell'intestino. Studi condotti con questo ormone indicano che è derivato da un precursore "proGIP" di 153 aminoacidi, che ha due peptidi segnale alle estremità N- e C-terminali, che vengono scissi per produrre un peptide attivo di 42 residui..
L'emivita di GIP è inferiore a 7 minuti una volta sintetizzata ed elaborata enzimaticamente. Questo peptide è riconosciuto da uno specifico recettore, il GIPR, che si trova nella membrana plasmatica delle cellule del pancreas, nello stomaco, nell'intestino tenue, nel tessuto adiposo, nella corteccia surrenale, nella ghiandola pituitaria, in il cuore, i polmoni e altri organi principali.
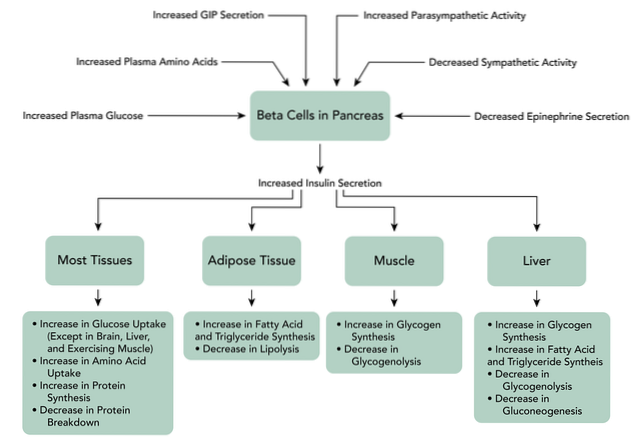
Quando il GIP si lega ai suoi recettori sulle cellule beta del pancreas, innesca un aumento della produzione di cAMP, anche l'inibizione dei canali del potassio dipendenti dall'ATP, l'aumento del calcio intracellulare e, infine, l'esocitosi dei granuli di accumulo di insulina.
Inoltre, questo peptide può stimolare la trascrizione genica e la biosintesi dell'insulina, così come gli altri componenti delle cellule beta pancreatiche per "censire" il glucosio. Sebbene il GIP funzioni principalmente come un ormone incretina, esercita anche altre funzioni in altri tessuti come il sistema nervoso centrale, le ossa, tra gli altri..
GLP-1: peptide simile al glucagone 1
Questo peptide è prodotto dal gene che codifica per "proglucagone", quindi è un peptide che condivide quasi il 50% di identità con la sequenza del glucagone ed è quindi chiamato peptide "simile al glucagone".
GLP-1, un prodotto proteolitico post-traduzionale, è tessuto-specifico ed è prodotto dalle cellule L dell'intestino in risposta all'assunzione di cibo. Come la GIP, questa incretina ha la capacità di aumentare la secrezione di insulina stimolata dal glucosio.
Espressione ed elaborazione genica
Questo peptide è codificato in uno degli esoni del gene proglucagone, che è espresso nelle cellule alfa del pancreas, nelle cellule L dell'intestino (nell'ileo distale) e nei neuroni del tronco cerebrale e dell'ipotalamo.
Nel pancreas l'espressione di questo gene è stimolata dal digiuno e dall'ipoglicemia (basse concentrazioni di glucosio nel sangue) ed è inibita dall'insulina. Nelle cellule intestinali, l'espressione del gene per il proglucagone è attivata da livelli aumentati di cAMP e assunzione di cibo.
Il prodotto risultante dall'espressione di questo gene viene elaborato post-traduzionalmente nelle cellule L enteroendocrine (nell'intestino tenue), determinando non solo il rilascio del peptide 1 simile al glucagone, ma anche altri fattori alquanto sconosciuti come la glicentina, ossitomodulina, peptide 2 simile al glucagone, ecc..
Produzione e azione
L'ingestione di cibi, soprattutto quelli ricchi di grassi e carboidrati, stimola la secrezione del peptide GLP-1 dalle cellule L enteroendocrine intestinali (può verificarsi anche stimolazione nervosa o stimolazione mediata da molti altri fattori).
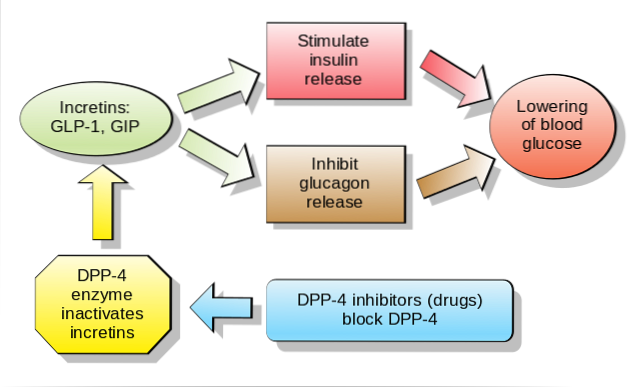
Negli esseri umani e nei roditori, questo peptide viene rilasciato nel flusso sanguigno in due fasi: 10-15 minuti dopo l'ingestione e 30-60 minuti dopo. La vita attiva di questo ormone nel sangue è inferiore a 2 minuti, poiché viene rapidamente inattivato proteoliticamente dall'enzima dipeptidil peptidasi-4 (DPP-4).
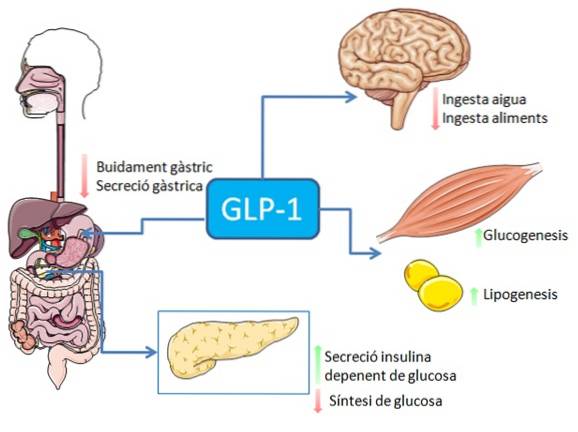
GLP-1 si lega a uno specifico recettore di membrana (GLP-1R) su varie cellule del corpo, comprese alcune cellule endocrine del pancreas, dove stimola la secrezione di insulina dipendente dal glucosio.
Come?
Il legame del GLP-1 al suo recettore sulle cellule beta del pancreas attiva la produzione di cAMP mediata dall'adenilato ciclasi in queste cellule. Esiste un'inibizione diretta dei canali del potassio dipendenti dall'ATP, che depolarizza la membrana cellulare.
Successivamente, i livelli di calcio intracellulare aumentano, che è il risultato dell'afflusso di calcio extracellulare dipendente da GLP-1 attraverso canali del calcio voltaggio-dipendenti, l'attivazione di canali cationici non selettivi e la mobilizzazione delle riserve di calcio..
Aumenta anche la sintesi di ATP mitocondriale, che favorisce la depolarizzazione. Successivamente i canali del potassio voltaggio-dipendenti vengono chiusi, impedendo la ripolarizzazione delle cellule beta e, infine, si verifica l'esocitosi dei granuli di immagazzinamento dell'insulina..
Nel sistema gastrointestinale, il legame del GLP-1 ai suoi recettori ha un effetto inibitorio sulla secrezione acida gastrica e sullo svuotamento gastrico, che attenua l'aumento dei livelli di glucosio nel sangue associato all'assunzione di cibo..
Riferimenti
- Baggio, L. L. e Drucker, D. J. (2007). Biologia delle incretine: GLP-1 e GIP. Gastroenterologia, 132 (6), 2131-2157.
- Deacon, C. F., e Ahrén, B. (2011). Fisiologia delle incretine nella salute e nella malattia. La revisione degli studi sul diabete: RDS, 8 (3), 293.
- Grossman, S. (2009). Differenziare le terapie con incretina in base all'attività della struttura e al metabolismo: concentrarsi su Liraglutide. Farmacoterapia: The Journal of Human Pharmacology and Drug Therapy, 29 (12P2), 25S-32S.
- Kim, W., & Egan, J. M. (2008). Il ruolo delle incretine nell'omeostasi del glucosio e nel trattamento del diabete. Recensioni farmacologiche, 60 (4), 470-512.
- Nauck, M. A. e Meier, J. J. (2018). Ormoni incretinici: il loro ruolo nella salute e nella malattia. Diabete, obesità e metabolismo, 20, 5-21.
- Rehfeld, J. F. (2018). L'origine e la comprensione del concetto di incretina. Frontiere in endocrinologia, 9.
- Vilsbøll, T. e Holst, J. J. (2004). Incretine, secrezione di insulina e diabete mellito di tipo 2. Diabetologia, 47 (3), 357-366



Nessun utente ha ancora commentato questo articolo.