
Caratteristiche, struttura, tipi e funzioni degli istoni
Il istoni sono proteine di base che interagiscono con il DNA per la formazione dei nucleosomi, che costituiscono i filamenti di cromatina che compongono i cromosomi negli organismi eucarioti.
I nucleosomi, complessi costituiti da DNA e proteine, sono stati scoperti nel 1974 e sono gli istoni che assemblano questo livello basale di organizzazione della cromatina. Tuttavia, l'esistenza delle proteine istoniche è nota da prima degli anni '60..
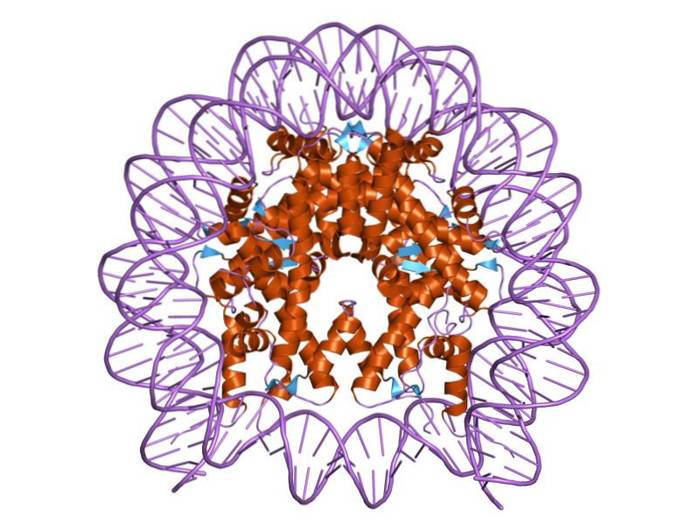
Gli istoni sono organizzati in modo tale che il DNA a doppia banda si avvolga attorno a un centro proteico costituito da queste proteine che interagiscono strettamente tra loro. Il centro dell'istone ha la forma di un disco e il DNA gira circa 1,7 volte intorno ad esso..
Molteplici legami idrogeno consentono al DNA di legarsi al centro proteico formato dagli istoni in ciascun nucleosoma. Questi legami si formano, per la maggior parte, tra la spina dorsale degli amminoacidi degli istoni e la spina dorsale zucchero-fosfato del DNA. Partecipano anche alcune interazioni idrofobiche e legami ionici.
Le proteine note come "complessi di rimodellamento della cromatina" sono responsabili della rottura e della formazione dei legami di giunzione tra DNA e istoni, consentendo l'ingresso del macchinario trascrizionale nel DNA contenuto nei nucleosomi.
Nonostante la vicinanza degli acidi nucleici al centro proteico formato dagli istoni, questi sono disposti in modo tale da consentire, se necessario, l'ingresso di fattori di trascrizione e di altre proteine legate all'espressione genica o al silenziamento genico..
Gli istoni possono subire varie modificazioni che generano molteplici varianti, rendendo possibile l'esistenza di tante forme differenti di cromatina che hanno la proprietà di modulare l'espressione genetica in modi differenti..
Indice articolo
- 1 Caratteristiche
- 2 Struttura
- 2.1 Legare gli istoni
- 3 tipi
- 3.1 Istoni nucleosomiali
- 3.2 Istoni leganti
- 4 funzioni
- 5 Riferimenti
Caratteristiche
Sono una delle proteine eucariotiche più conservate in natura. Ad esempio, è stato dimostrato che l'istone H4 del pisello differisce solo in due delle 102 posizioni amminoacidiche della proteina H4 della mucca..
Gli istoni sono proteine relativamente piccole, con non più di 140 aminoacidi. Sono ricchi di residui amminoacidici basici, quindi hanno una carica netta positiva, che contribuisce alla loro interazione con l'acido nucleico caricato negativamente per formare nucleosomi..
Sono noti istoni nucleosomiali e a ponte. Gli istoni nucleosomiali sono H3, H4, H2A e H2B, mentre gli istoni leganti appartengono alla famiglia degli istoni H1.
Durante l'assemblaggio del nucleosoma, vengono inizialmente formati dimeri specifici H3-H4 e H2A-H2B. Due dimeri H3-H4 si uniscono quindi per formare tetrameri che in seguito si combinano con i dimeri H2A-H2B, formando il centro ottamerica..
Tutti gli istoni vengono sintetizzati principalmente durante la fase S del ciclo cellulare ei nucleosomi vengono assemblati nelle eliche nascenti del DNA, subito dopo la forcella di replicazione..
Struttura
La struttura generale degli istoni comprende una regione di amminoacidi basici e una regione carbossilica globulare altamente conservata tra gli organismi eucariotici..
Un motivo strutturale noto come "piega istonica", composto da tre eliche alfa collegate da due forcine e formanti un piccolo centro idrofobo, è responsabile delle interazioni proteina-proteina tra gli istoni che compongono il nucleosoma..
È questa piega degli istoni che costituisce il dominio carbossilico globulare di queste proteine nucleosomiali in tutti gli eucarioti..
Gli istoni hanno anche piccole "code" o regioni ammino-terminali e altre regioni carbossil-terminali (accessibili alle proteasi), lunghe non più di 40 amminoacidi. Entrambe le regioni sono ricche di aminoacidi basici che possono subire molteplici modificazioni covalenti post-traduzionali..
Istoni leganti
Negli eucarioti ci sono due famiglie di istoni leganti, differenziati l'uno dall'altro per la loro struttura. Alcuni hanno una struttura tripartita, con il dominio globulare sopra descritto affiancato da domini N- e C-terminali "non strutturati"; mentre altri hanno solo un dominio C-terminal.
Sebbene la maggior parte degli istoni sia conservata, possono sorgere varianti specifiche durante l'embriogenesi o la maturazione di cellule specializzate in alcuni organismi. Alcune variazioni strutturali hanno a che fare con modifiche post-traduzionali come le seguenti:
-Fosforilazione: si pensa sia correlato alla modifica del grado di condensazione della cromatina e si verifica comunemente nei residui di serina.
-Acetilazione: associato a regioni cromosomiche che sono trascrizionalmente attive. Normalmente si verifica sulle catene laterali dei residui di lisina. Quando si verificano su questi residui, la loro carica positiva diminuisce, diminuendo così l'affinità delle proteine per il DNA..
-Metilazione: può verificarsi come mono-, di- o trimetilazione di residui di lisina che sporgono dal nucleo proteico.
Gli enzimi specifici sono responsabili di queste modificazioni covalenti negli istoni. Questi enzimi includono istone-acetil transferasi (HAT), complessi istone-deacetilasi (HDAC) e istone-metiltransferasi e demetilasi..
Tipi
La caratterizzazione degli istoni è stata effettuata mediante varie tecniche biochimiche, tra le quali spiccano le cromatografie che si basano su resine a scambio cationico deboli..
Alcuni autori stabiliscono una forma di classificazione in cui si distinguono 5 tipi principali di istoni negli eucarioti: FI, con 21 kDa di proteine; F2A1 o FIV, di più o meno 11,3 kDa; F2A2 o FIIbI, 14,5 kDa; F2B o FIIb2, con un peso molecolare di 13,7 kDa, e F3 o FIII, di 15,3 kDa.
Tutti questi tipi di istoni, ad eccezione del gruppo IF, si trovano in quantità equimolari nelle cellule..
Un'altra classificazione, con la stessa validità e forse la più utilizzata oggi, propone l'esistenza di due diversi tipi di istoni, ovvero: quelli che fanno parte dell'ottamero del nucleosoma e gli istoni di legame o ponte, che uniscono i nucleosomi tra Sì.
Alcune varianti possono anche verificarsi tra le specie e, a differenza degli istoni centrali, le varianti vengono sintetizzate durante l'interfase e vengono inserite nella cromatina preformata attraverso un processo dipendente dall'energia rilasciata dall'idrolisi dell'ATP..
Istoni nucleosomiali
Il centro di un nucleosoma è costituito da una coppia di ciascuno dei quattro istoni costituenti: H2a, H2b, H3 e H4; su cui sono avvolti segmenti di DNA di circa 145 paia di basi.
Gli istoni H4 e H2B sono, in linea di principio, invariabili. Alcune variazioni sono evidenti, tuttavia, negli istoni H3 e H2A, le cui proprietà biofisiche e biochimiche alterano la normale natura del nucleosoma..
Una variante dell'istone H2A nell'uomo, la proteina H2A.Z ha un'ampia regione acida e può promuovere la stabilità del nucleosoma a seconda delle varianti dell'istone H3 a cui è associata..
Questi istoni mostrano una certa variabilità tra le specie, un caso speciale è quello dell'istone H2B, per il quale il primo terzo della molecola è molto variabile..
Istoni leganti
Gli istoni di legame o ponte sono istoni di classe H1. Questi sono responsabili dell'unione tra i nucleosomi e della protezione del DNA che sporge all'inizio e alla fine di ogni particella..
A differenza degli istoni nucleosomiali, non tutti gli istoni di tipo H1 possiedono la regione globulare della "piega" istonica. Queste proteine si legano al DNA tra i nucleosomi, facilitando uno spostamento dell'equilibrio della cromatina verso uno stato più condensato e meno attivo, trascrizionalmente parlando..
Gli studi hanno collegato questi istoni all'invecchiamento, alla riparazione del DNA e ai processi apoptotici, motivo per cui si ritiene che svolgano un ruolo cruciale nel mantenimento dell'integrità genomica.
Caratteristiche
Tutti i residui amminoacidici degli istoni partecipano, in un modo o nell'altro, alla loro interazione con il DNA, il che spiega il fatto che siano così conservati tra i regni degli organismi eucarioti.
La partecipazione degli istoni al confezionamento del DNA sotto forma di cromatina è di grande rilevanza per organismi multicellulari complessi in cui le diverse linee cellulari possono specializzarsi solo modificando l'accessibilità dei loro geni al macchinario trascrizionale..
Le regioni genomiche trascrizionalmente attive sono dense nei nucleosomi, suggerendo che l'associazione del DNA con le proteine istoniche è cruciale per la regolazione negativa o positiva della loro trascrizione..
Allo stesso modo, per tutta la vita di una cellula, la risposta a un gran numero di stimoli, sia interni che esterni, dipende da piccoli cambiamenti nella cromatina, che normalmente hanno a che fare con il rimodellamento e la modifica post-traduzionale degli istoni trovati in stretta relazione con DNA.
Più variabili istoniche svolgono funzioni diverse negli eucarioti. Uno di questi ha a che fare con la partecipazione di una variante dell'istone H3 alla formazione delle strutture centromeriche responsabili della segregazione dei cromosomi durante la mitosi..
La controparte di questa proteina in altri eucarioti ha dimostrato di essere essenziale per l'assemblaggio del cinetocore proteico a cui i microtubuli del fuso si legano durante la mitosi e la meiosi..
Riferimenti
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K. e Walter, P. (2015). Biologia molecolare della cellula (6a ed.). New York: Garland Science.
- Campos, E. I., & Reinberg, D. (2009). Istoni: annotazione della cromatina. Annu. Rev. Genet., 43, 559-599.
- Harvey, A. C. e Downs, J. A. (2004). Quali funzioni forniscono gli istoni del linker? Microbiologia molecolare, 53, 771-775.
- Henikoff, S. e Ahmad, K. (2005). Assemblaggio di istoni varianti in cromatina. Annu. Rev. Cell. Dev. Biol., ventuno, 133-153.
- Isenberg, I. (1979). Istoni. Annu. Rev. Biochem., 48, 159-191.
- Kornberg, R. D. e Thomas, J. O. (1974). Struttura della cromatina: oligomeri degli istoni. Scienza, 184(4139), 865-868.
- Smith, E., DeLange, R. e Bonner, J. (1970). Chimica e biologia degli istoni. Recensioni fisiologiche, cinquanta(2), 159-170.



Nessun utente ha ancora commentato questo articolo.