
Strutture, funzioni, forme dell'esochinasi

Il esochinasi (HK) è l'enzima che catalizza la prima reazione della via glicolitica in quasi tutti gli organismi viventi, sia procarioti che eucarioti. È responsabile del trasferimento di un gruppo fosforile al glucosio, producendo glucosio-6P, sebbene possa anche fosforilare altri zuccheri esosi (6 atomi di carbonio).
Questo enzima è classificato all'interno di una delle due famiglie di enzimi glucosio chinasi (enzimi che trasferiscono gruppi fosforilici a substrati come il glucosio): la famiglia esochinasi (HK), i cui membri sono suddivisi in tre diversi gruppi noti come gruppo HK, il gruppo A e gruppo B.
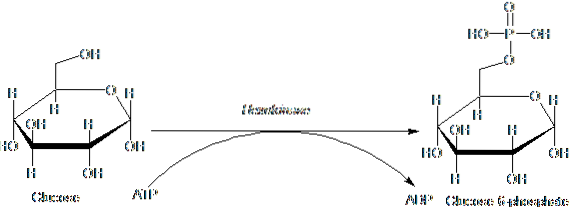
Gli enzimi appartenenti alla famiglia HK sono caratterizzati dalla fosforilazione del glucosio a scapito dell'ATP come molecola donatrice del gruppo fosforile, e i suoi membri differiscono tra loro principalmente per quanto riguarda il loro peso molecolare e la specificità del substrato..
Il gruppo HK comprende gli enzimi degli organismi eucariotici (ATP: D-esoso 6-fosfotransferasi), mentre il gruppo A è rappresentato dagli enzimi di batteri gram-negativi, cianobatteri, protisti amitocondriati e tripanosomatidi, e il gruppo B contiene gli enzimi gram-positivi batteri e organismi crenoqueotici.
Gli enzimi del gruppo A e B sono noti anche come glucokinasi (GlcKs), in quanto sono in grado di fosforilare esclusivamente il glucosio, motivo per cui questi enzimi sono chiamati ATP: D-glucosio 6-fosfotransferasi.
In quanto enzima glicolitico, l'esochinasi ha una grande importanza metabolica, poiché senza di essa questa importante via non sarebbe possibile e le cellule altamente dipendenti dal consumo di carboidrati, come il cervello e le cellule muscolari di molti mammiferi, avrebbero gravi impedimenti funzionali e fisiologici in generale.
Indice articolo
- 1 Struttura
- 2 funzioni
- 2.1 Nelle piante
- 3 forme
- 4 Riferimenti
Struttura
Come si vedrà più avanti, esistono diversi tipi di enzimi esochinasi nei mammiferi e in altri vertebrati (così come negli organismi unicellulari come il lievito). Nei mammiferi sono state descritte quattro: isoforme I, II, III e IV.
I primi tre isoenzimi hanno un peso molecolare di 100 kDa, ma l'isoenzima IV ha 50 kDa. Questi isoenzimi (specialmente I-III) mostrano un'elevata somiglianza di sequenza tra loro rispetto ai loro terminali C e N, così come con altri membri della famiglia delle esochinasi..
Il dominio N-terminale di questi enzimi è considerato il dominio "regolatore", mentre l'attività catalitica è svolta dal dominio C-terminale (il mammifero HK II ha siti attivi in entrambi i domini).
Il dominio N-terminale è collegato al dominio C-terminale tramite un'alfa elica, ciascuno ha un peso molecolare di circa 50 kDa e ha un sito di legame per il glucosio.
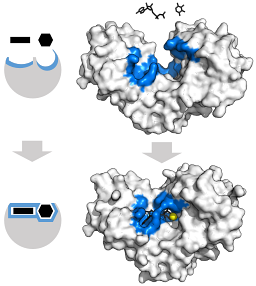
La struttura terziaria di questi enzimi è essenzialmente composta da fogli β-piegati mescolati ad alfa eliche, la cui proporzione varia rispetto all'enzima e alla specie in questione; il sito di legame per ATP, l'altro substrato per esochinasi, è solitamente composto da cinque fogli β e due eliche alfa.
Caratteristiche
L'esochinasi ha una funzione trascendentale nel metabolismo dei carboidrati della maggior parte degli esseri viventi, poiché catalizza il primo passo della via glicolitica, mediando la fosforilazione del glucosio all'interno della cellula..
Questa prima fase della glicolisi, che consiste nel trasferimento di un gruppo fosforile da ATP (donatore) a glucosio, producendo glucosio 6-fosfato e ADP, è la prima delle due fasi di investimento energetico sotto forma di ATP.
Inoltre, la reazione catalizzata dall'esochinasi è la fase di "attivazione" del glucosio per la sua successiva elaborazione e rappresenta una fase di "impegno", poiché il glucosio così fosforilato non può lasciare la cellula tramite i suoi trasportatori convenzionali nella membrana..
Il prodotto della reazione catalizzata dall'esochinasi, cioè il glucosio 6-fosfato, è un punto di diramazione, poiché è il primo substrato utilizzato nella via del pentoso fosfato e nella sintesi del glicogeno in molti animali (e dell'amido nelle piante).
Nelle piante
La funzione dell'esochinasi nelle piante non è molto diversa da quella degli animali o dei microrganismi, tuttavia, nelle piante superiori questo enzima funziona anche come "sensore" della concentrazione degli zuccheri..
L'importanza di questa funzione in questi organismi ha a che fare con la partecipazione degli zuccheri come fattori regolatori nell'espressione di geni coinvolti in diversi processi metabolici come:
- Fotosintesi
- Il ciclo gliossilato
- Il respiro
- La degradazione o sintesi di amido e saccarosio
- Metabolismo dell'azoto
- Difesa contro gli agenti patogeni
- Regolazione del ciclo cellulare
- La risposta di guarigione
- Pigmentazione
- Senescenza, tra gli altri.
Questa funzione di esochinasi come "sensore" della quantità di glucosio intracellulare è stata descritta anche per lieviti e mammiferi..
Forme
In natura esistono diverse forme di esochinasi e questo dipende fondamentalmente dalla specie considerata.
Nell'uomo e in altri animali vertebrati, ad esempio, è stata dimostrata l'esistenza di 4 diverse isoforme dell'enzima esochinasi nel compartimento citosolico, che sono state indicate con i numeri romani I, II, III e IV.
Gli isoenzimi I, II e III hanno un peso molecolare di 100 kDa, sono inibiti dal loro prodotto di reazione (glucosio 6-fosfato) e sono molto correlati al glucosio, cioè hanno una costante Km molto bassa. Tuttavia, questi enzimi hanno una scarsa specificità del substrato, essendo in grado di fosforilare altri esosi come fruttosio e mannosio.
L'isoenzima IV, noto anche come glucokinase (GlcK), ha solo 50 kDa di peso molecolare e, pur essendo scarsamente correlato (valori di Km elevati), ha un'elevata specificità per il glucosio come substrato e non è soggetto ad essi. gli altri tre isoenzimi.
La glucochinasi (isoenzima IV della esochinasi di molti mammiferi) si trova principalmente nel fegato e aiuta questo organo nella “regolazione” della sua velocità di consumo di glucosio in risposta alle variazioni di questo substrato nel sangue circolante..
I tre geni che codificano per esochinasi I, II e III negli animali sembrano avere lo stesso antenato di 50 kDa che è stato duplicato e fuso nel genoma, il che sembra evidente quando si osserva che l'attività catalitica delle forme I e III risiede solo a l'estremità C-terminale.
Riferimenti
- Aronoff, S. L., Berkowitz, K., Shreiner, B. e Want, L. (2004). Metabolismo e regolazione del glucosio: oltre l'insulina e il glucagone. Spettro del diabete, 17(3), 183-190.
- Harrington, G. N., e Bush, D. R. (2003). Il ruolo bifunzionale della esochinasi nel metabolismo e nella segnalazione del glucosio. La cellula vegetale, quindici(11), 2493-2496.
- Jang, J. C., León, P., Zhou, L. e Sheen, J. (1997). Esochinasi come sensore di zucchero nelle piante superiori. La cellula vegetale, 9(1), 5-19.
- Kawai, S., Mukai, T., Mori, S., Mikami, B. e Murata, K. (2005). Ipotesi: strutture, evoluzione e antenato delle glucosio chinasi nella famiglia delle esochinasi. Journal of Bioscience and Bioengineering, 99(4), 320-330.
- Mathews, K. E. (1998). Van Holde. Biochimica.
- Wilson, J. E. (2003). Isoenzimi della esochinasi dei mammiferi: struttura, localizzazione subcellulare e funzione metabolica. Giornale di biologia sperimentale, 206(12), 2049-2057.

Nessun utente ha ancora commentato questo articolo.