
Proprietà, comportamento, forma, esempi dei gas

Il gas Sono tutte quelle sostanze o composti i cui stati di aggregazione sono deboli e dispersi, allo stesso tempo che dipendono molto dalle condizioni di pressione e temperatura che li governano. Sono forse la seconda forma di materia più abbondante nell'intero universo dopo il plasma..
Sulla Terra, i gas costituiscono gli strati dell'atmosfera, dall'esosfera alla troposfera e all'aria che respiriamo. Sebbene un gas sia invisibile quando viene diffuso attraverso ampi spazi, come il cielo, viene rilevato dal movimento delle nuvole, dai giri delle pale di un mulino, o dai vapori esalati dalle nostre bocche nei climi freddi..

Allo stesso modo, andando agli aspetti ambientali negativi, si osserva nel fumo nero dai tubi di scappamento dei veicoli, nelle colonne di fumo delle torri situate negli stabilimenti, o nel fumo alzato quando un bosco brucia.
Stai affrontando fenomeni gassosi anche quando vedi vapori che fuoriescono dalle fogne, nei ciuffi di paludi e cimiteri, nel gorgogliare all'interno delle vasche dei pesci, nei palloncini di elio che vengono rilasciati nel cielo, nell'ossigeno rilasciato dalle piante come risultato della loro fotosintesi, e anche in eruttazione e flatulenza.
Ovunque si osservino gas significa che c'è stata una reazione chimica, a meno che non siano fissati o assimilati direttamente dall'aria, la principale fonte di gas (superficialmente) sul pianeta. All'aumentare della temperatura, tutte le sostanze (elementi chimici) si trasformeranno in gas, inclusi metalli come ferro, oro e argento..
Indipendentemente dalla natura chimica dei gas, condividono tutti la grande distanza che separa le loro particelle (atomi, molecole, ioni, ecc.), Che si muovono in modo caotico e arbitrario attraverso un dato volume o spazio..
Indice articolo
- 1 Proprietà dei gas
- 1.1 Fisico
- 1.2 Conducibilità elettrica e termica
- 1.3 Reattività
- 2 Comportamento dei gas
- 3 Forma di gas
- 4 Pressione di un gas
- 4.1 Unità
- 5 Volume di un gas
- 6 Principali leggi sui gas
- 6.1 Legge di Boyle
- 6.2 Legge Charles
- 6.3 Legge di Gay-Lussac
- 6.4 Legge di Avogadro
- 7 Tipi di gas
- 7.1 Gas combustibili
- 7.2 Gas industriali
- 7.3 Gas inerti
- 8 Esempi di elementi e composti gassosi
- 8.1 Composti gassosi
- 9 Riferimenti
Proprietà dei gas
Fisico
Le proprietà fisiche dei gas variano a seconda della sostanza o del composto coinvolto. I gas sono comunemente associati a cattivi odori o putrefazione, sia per il loro contenuto di zolfo, sia per la presenza di ammine volatili. Allo stesso modo, sono visualizzati con colorazioni verdastre, marroni o giallastre, che intimidiscono e danno un cattivo presagio.
Tuttavia, la maggior parte dei gas, o almeno quelli più abbondanti, sono in realtà incolori e inodori. Sebbene siano sfuggenti, si possono sentire sulla pelle e resistono al movimento, creando anche strati viscosi sui corpi che li attraversano (come accade con gli aeroplani)..
Tutti i gas possono subire variazioni di pressione o temperatura che finiscono per trasformarli nei rispettivi liquidi; cioè subiscono condensa (se raffreddati) o liquefazione (se “pressati”).

D'altra parte, i gas sono in grado di dissolversi in liquidi e alcuni solidi porosi (come il carbone attivo). Le bolle sono il risultato di accumuli di gas che non si sono ancora disciolti nel mezzo e sfuggono verso la superficie del liquido..
Conducibilità elettrica e termica
In condizioni normali (senza ionizzazione delle loro particelle), i gas sono cattivi conduttori di calore ed elettricità. Tuttavia, quando sono stressati da molti elettroni, lasciano che la corrente li attraversi, come si vede nei fulmini durante i temporali..
D'altra parte, a basse pressioni e sottoposti a un campo elettrico, alcuni gas, soprattutto quelli nobili o perfetti, si accendono e le loro luci sono utilizzate per la progettazione di pubblicità e manifesti notturni (luci al neon), oltre che nei famose lampade a scarica elettrica nelle lanterne stradali.
Per quanto riguarda la conducibilità termica, molti gas si comportano come isolanti termici, quindi la loro incorporazione nell'imbottitura di fibre, tessuti o pannelli di vetro, aiuta a impedire il passaggio del calore e mantiene la temperatura costante..
Tuttavia, ci sono gas che sono buoni conduttori di calore e possono causare ustioni peggiori di quelle causate da liquidi o solidi; ad esempio, come con il vapore caldo dei cupcakes al forno (o empanadas), o dai getti di vapore che fuoriescono dalle caldaie.
Reattività
In generale, le reazioni che coinvolgono i gas, o dove si verificano, sono classificate come pericolose e ingombranti.
La loro reattività dipende, ancora una volta, dalla loro natura chimica; Tuttavia, quando si espande e si mobilita con grande facilità, è necessario esercitare maggiore cura e controllo perché possono innescare drastici aumenti di pressione che mettono a rischio la struttura del reattore; per non parlare di quanto siano infiammabili o non beati i gas.
Comportamento dei gas
Macroscopicamente si può avere un'idea del comportamento dei gas osservando come si evolvono nell'aria il fumo, gli anelli o le "lingue" letterarie delle sigarette. Allo stesso modo, quando una granata fumogena esplode, è interessante dettagliare il movimento di queste nuvole di colore diverso.
Tuttavia, tali osservazioni sono soggette all'azione dell'aria, e anche al fatto che ci sono particelle solide molto fini sospese nel fumo. Pertanto, questi esempi non sono sufficienti per giungere a una conclusione sul vero comportamento di un gas. Invece, sono stati condotti esperimenti ed è stata sviluppata la teoria cinetica dei gas..
Molecolarmente e idealmente, le particelle gassose collidono elasticamente tra loro, avendo spostamenti lineari, rotazionali e vibrazionali. Hanno un'energia media associata, che consente loro di viaggiare liberamente attraverso qualsiasi spazio senza quasi interagire o scontrarsi con un'altra particella mentre il volume intorno a loro aumenta..
Il suo comportamento sarebbe diventato un misto del movimento irregolare browniano e delle collisioni di alcune palle da biliardo che rimbalzano incessantemente tra loro e le pareti del tavolo; se non ci sono muri, si diffonderanno verso l'infinito, a meno che non siano trattenuti da una forza: la gravità.
Forma di gas
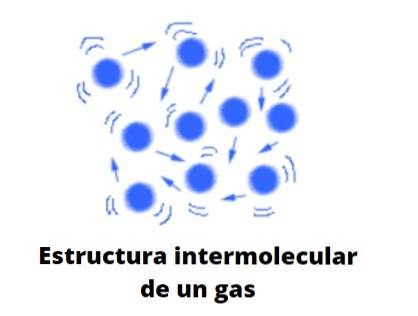
I gas, a differenza dei liquidi e dei solidi, non sono materia del tipo condensato; cioè, l'aggregazione o la coesione delle sue particelle non riesce mai a definire una forma. Condividono con i liquidi il fatto che occupano completamente il volume del contenitore che li contiene; tuttavia, mancano di tensione superficiale e superficiale.
Se la concentrazione di gas è elevata, si possono vedere ad occhio nudo le sue “lingue” o le forme macroscopiche già descritte. Questi, prima o poi, finiranno per svanire per azione del vento o per mera espansione del gas. I gas quindi ricoprono tutti gli angoli dello spazio limitato dando origine a sistemi altamente omogenei.
Ora, la teoria considera opportunamente i gas come sfere che difficilmente entrano in collisione con se stesse; ma quando lo fanno, rimbalzano elasticamente.
Queste sfere sono ampiamente separate l'una dall'altra, quindi i gas sono praticamente "pieni" di vuoto; da qui la sua versatilità di passare attraverso la minima fessura o fessura, e la facilità di poterle comprimere in modo significativo.
Ecco perché, non importa quanto sia chiusa un'installazione di panetteria, se ci cammini accanto è sicuro che apprezzerai l'aroma del pane appena sfornato..
Pressione di un gas
Si potrebbe ritenere che, poiché le sfere o le particelle del gas sono così disperse e separate, non sono in grado di generare alcuna pressione sui corpi o sugli oggetti. Tuttavia, l'atmosfera dimostra che tale credenza è falsa: ha massa, peso e impedisce ai liquidi di evaporare o bollire dal nulla. I punti di ebollizione vengono misurati alla pressione atmosferica.
Le pressioni dei gas diventano più quantificabili se sono disponibili manometri, o se sono racchiusi in contenitori con pareti indeformabili. Pertanto, più particelle di gas ci sono all'interno del contenitore, maggiore è il numero di collisioni tra loro e le pareti del contenitore..
Queste particelle, quando entrano in collisione con le pareti, le premono, poiché esercitano sulla loro superficie una forza proporzionale alla loro energia cinetica. È come se le palle da biliardo ideali venissero lanciate contro un muro; se ce ne sono molti che li colpiscono ad alta velocità, potrebbe persino rompersi.
Unità
Ci sono molte unità che accompagnano le misurazioni della pressione del gas. Alcuni dei più noti sono millimetri di mercurio (mmHg), come torr. Ci sono quelli del sistema internazionale di unità (SI) che definiscono il pascal (Pa) in termini di N / mDue; e di lui, il chilo (kPa), il mega (MPa) e il giga (GPa) pascal.
Volume di un gas
Un gas occupa e si espande per tutto il volume del contenitore. Più grande è il contenitore, anche il volume del gas sarà; ma sia la sua pressione che la densità diminuiranno per la stessa quantità di particelle.
Il gas stesso, invece, ha un volume associato che non dipende tanto dalla sua natura o struttura molecolare (idealmente), ma dalle condizioni di pressione e temperatura che lo governano; questo è il suo volume molare.
In realtà il volume molare varia da un gas all'altro, anche se le variazioni sono piccole se non si tratta di molecole grandi ed eterogenee. Ad esempio, il volume molare dell'ammoniaca (NH3, 22.079 L / mol) a 0 ºC e 1 atm, differisce dall'elio (He, 22.435 L / mol).
Tutti i gas hanno un volume molare che cambia in funzione di P e T, e non importa quanto siano grandi le loro particelle, il loro numero è sempre lo stesso. Da qui infatti è derivato ciò che è noto con il numero di Avogadro (NPER).
Principali leggi sui gas
Il comportamento dei gas è stato studiato per secoli attraverso esperimenti, osservazioni approfondite e interpretazione dei risultati..
Tali esperimenti hanno permesso di stabilire una serie di leggi che, messe insieme nella stessa equazione (quella dei gas ideali), aiutano a prevedere le risposte di un gas a differenti condizioni di pressione e temperatura. In questo modo, esiste una relazione tra il suo volume, temperatura e pressione, nonché il numero delle sue moli in un dato sistema..
Tra queste leggi ci sono le seguenti quattro: Boyle, Charles, Gay-Lussac e Avogadro.
Legge di Boyle
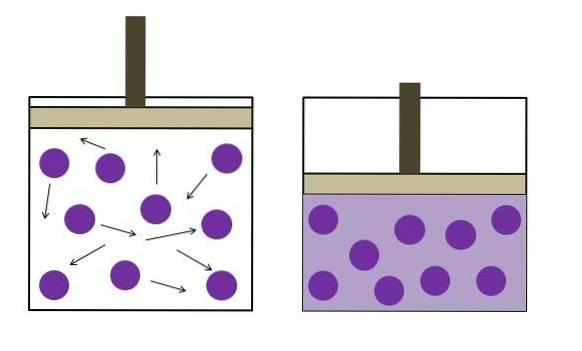
La legge di Boyle afferma che a temperatura costante, il volume di un gas ideale è inversamente proporzionale alla sua pressione; ovvero, più grande è il contenitore, minore sarà la pressione che subiranno le sue pareti a causa della stessa quantità di gas..
Charles Law

La legge di Charles afferma che a pressione costante, il volume di un gas ideale è direttamente proporzionale alla sua temperatura. I palloncini dimostrano la legge di Charles, perché se vengono riscaldati si gonfiano un po 'di più, mentre se sono immersi in azoto liquido, si sgonfiano perché il volume del gas al loro interno si contrae..
Legge Gay-Lussac
La legge di Gay-Lussac afferma che a volume costante, la pressione di un gas ideale è direttamente proporzionale alla sua temperatura. In un calderone ben chiuso, se un gas viene riscaldato progressivamente, ogni volta la pressione al suo interno sarà maggiore, perché le pareti del calderone non si deformano né si dilatano; cioè il suo volume non cambia, è costante.
Legge di Avogadro
Infine, la legge di Avogadro afferma che il volume occupato da un gas ideale è direttamente proporzionale al numero delle sue particelle. Quindi, se abbiamo una mole di particelle (6.02 · 102. 3), avremo quindi il volume molare del gas.
Tipi di gas
Gas combustibili
Sono quei gas i cui componenti funzionano come combustibili, perché sono utilizzati per la produzione di energia termica. Alcuni di loro sono gas naturale, gas di petrolio liquefatto e idrogeno.
Gas industriali
Sono quei gas fabbricati, che sono commercializzati al pubblico per diversi usi e applicazioni, come per la salute, l'alimentazione, la protezione ambientale, la metallurgia, l'industria chimica, i settori della sicurezza, tra gli altri. Alcuni di questi gas sono ossigeno, azoto, elio, cloro, idrogeno, monossido di carbonio, propano, metano, protossido di azoto, tra gli altri..
Gas inerti
Sono quei gas che, in determinate condizioni di temperatura e pressione, non generano alcuna reazione chimica o molto bassa. Sono neon, argon, elio, krypton e xeno. Sono utilizzati nei processi chimici in cui sono necessari elementi non reattivi.
Esempi di elementi e composti gassosi
Quali sono gli elementi gassosi della tavola periodica in condizioni terrestri?
Per prima cosa abbiamo l'idrogeno (H), che forma le molecole H.Due. Segue l'elio (He), il gas nobile più leggero; e poi azoto (N), ossigeno (O) e fluoro (F). Questi ultimi tre formano anche molecole biatomiche: NDue, ODue e FDue.
Dopo il fluoro arriva il neon (Ne), il gas nobile che segue l'elio. Sotto il fluoro abbiamo il cloro (Cl), sotto forma di molecole di ClDue.
Successivamente abbiamo il resto dei gas nobili: argon (Ar), krypton (Kr), xenon (Xe), radon (Rn) e oganeson (Og).
Pertanto, sono un totale di dodici elementi gassosi; undici se escludiamo l'ogano altamente radioattivo e instabile.
Composti gassosi
Oltre agli elementi gassosi, verranno elencati alcuni composti gassosi comuni:
-HDueSì, idrogeno solforato, responsabile dell'odore delle uova marce
-NH3, ammoniaca, quell'aroma pungente che si trova nei saponi usati
-CODue, anidride carbonica, un gas serra
-NONDue, diossido di azoto
-NO, monossido di azoto, un gas ritenuto altamente tossico ma che svolge un ruolo importante nel sistema circolatorio
-SW3, triossido di zolfo
-C4H10, butano
-HCl, acido cloridrico
-O3, ozono
-SF6, esafluoruro di zolfo
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Le proprietà dei gas. Estratto da: chemed.chem.purdue.edu
- Wikipedia. (2019). Gas. Estratto da: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (5 dicembre 2018). Gas - Proprietà generali dei gas. Estratto da: thoughtco.com
- Harvard Men's Health Watch. (2019). Lo stato del gas. Estratto da: health.harvard.edu
- Editori di raffreddamento elettronico. (1 settembre 1998). La conducibilità termica dei gas. Estratto da: electronics-cooling.com



Nessun utente ha ancora commentato questo articolo.