
Londra forza caratteristiche ed esempi
Il Forze di Londra, Le forze di dispersione di Londra, o interazioni dipolo-dipolo indotte, sono il tipo più debole di interazioni intermolecolari. Il suo nome è dovuto ai contributi del fisico Fritz London e ai suoi studi nel campo della fisica quantistica.
Le forze di Londra spiegano come interagiscono le molecole le cui strutture e atomi gli rendono impossibile formare un dipolo permanente; vale a dire, si applica fondamentalmente a molecole apolari o atomi isolati di gas nobili. A differenza delle altre forze di Van der Waals, questa richiede distanze estremamente brevi.

Una buona analogia fisica delle forze di Londra può essere trovata nel funzionamento del sistema di chiusura in velcro (immagine sopra). Premendo un lato del tessuto ricamato con ganci e l'altro con fibre, si crea una forza attrattiva proporzionale all'area dei tessuti.
Una volta sigillate entrambe le facce, è necessario esercitare una forza per contrastare le loro interazioni (esercitate dalle nostre dita) per separarle. Lo stesso vale per le molecole: più sono voluminose o piatte, maggiori sono le loro interazioni intermolecolari a distanze molto brevi..
Tuttavia, non è sempre possibile avvicinarsi a queste molecole a una distanza sufficientemente ravvicinata da rendere apprezzabili le loro interazioni..
In questo caso richiedono temperature molto basse o pressioni molto elevate; come tale è il caso dei gas. Allo stesso modo, questi tipi di interazioni possono essere presenti in sostanze liquide (come l'n-esano) e sostanze solide (come lo iodio)..
Indice articolo
- 1 Caratteristiche
- 1.1 Distribuzione omogenea del carico
- 1.2 Polarizzabilità
- 1.3 È inversamente proporzionale alla distanza
- 1.4 È direttamente proporzionale alla massa molecolare
- 2 Esempi di forze di Londra
- 2.1 In natura
- 2.2 Alcani
- 2.3 Alogeni e gas
- 3 Riferimenti
Caratteristiche
Quali caratteristiche deve avere una molecola per poter interagire usando le forze di Londra? La risposta è che chiunque potrebbe farlo, ma quando c'è un momento di dipolo permanente, le interazioni dipolo-dipolo predominano più di quelle di dispersione, contribuendo molto poco alla natura fisica delle sostanze..
In strutture dove non ci sono atomi altamente elettronegativi o la cui distribuzione della carica elettrostatica è omogenea, non esiste un estremo o una regione che possa essere considerata ricca (δ-) o povera (δ +) di elettroni.
In questi casi devono intervenire altri tipi di forze o altrimenti questi composti potrebbero esistere solo in fase gassosa, indipendentemente dalle condizioni di pressione o temperatura che operano su di essi..
Distribuzione omogenea del carico
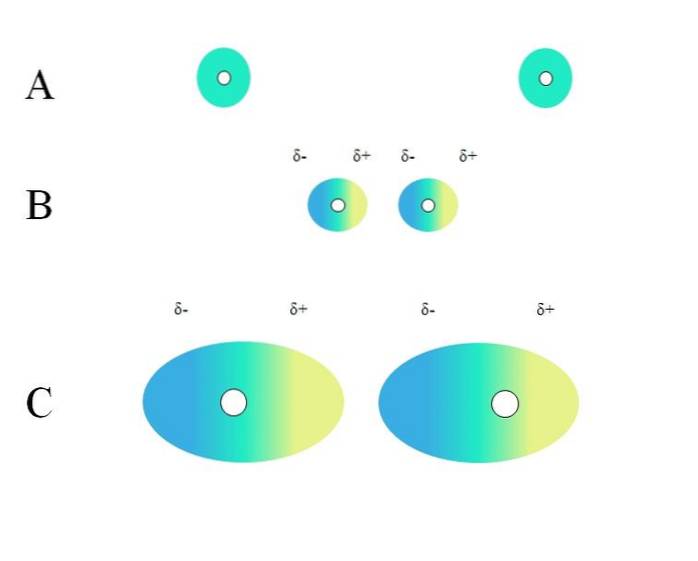
Due atomi isolati, come il neon o l'argon, hanno una distribuzione di carica omogenea. Questo può essere visto in A, immagine in alto. I cerchi bianchi al centro rappresentano i nuclei, per gli atomi, o lo scheletro molecolare, per le molecole. Questa distribuzione di carica può essere considerata come una nuvola di elettroni verde.
Perché i gas nobili rispettano questa omogeneità? Poiché hanno il loro guscio elettronico completamente pieno, quindi i loro elettroni dovrebbero teoricamente sentire la carica di attrazione del nucleo allo stesso modo in tutti gli orbitali..
D'altra parte, per altri gas, come l'ossigeno atomico (O), il suo guscio è incompleto (che si osserva nella sua configurazione elettronica) e lo costringe a formare la molecola biatomica ODue per compensare questa carenza.
I cerchi verdi in A possono anche essere molecole, piccole o grandi. La sua nuvola elettronica orbita attorno a tutti gli atomi che la compongono, specialmente quelli più elettronegativi. Attorno a questi atomi la nuvola sarà concentrata e sarà più negativa, mentre altri atomi avranno una carenza elettronica.
Tuttavia, questa nuvola non è statica ma dinamica, quindi a un certo punto si formeranno brevi regioni δ- e δ + e un fenomeno chiamato Polarizzazione.
Polarizzabilità
In A la nuvola verde indica una distribuzione omogenea della carica negativa. Tuttavia, la forza di attrazione positiva esercitata dal nucleo può oscillare sugli elettroni. Ciò provoca una deformazione della nuvola, creando così le regioni δ-, in blu, e δ +, in giallo..
Questo improvviso momento di dipolo nell'atomo o nella molecola può distorcere una nuvola di elettroni adiacente; in altre parole, induce un dipolo improvviso sul vicino (B, immagine in alto).
Questo perché la regione δ disturba la nube vicina, i suoi elettroni sentono repulsione elettrostatica e sono orientati al polo opposto, apparendo δ+.
Nota come i poli positivi si allineano con i poli negativi, proprio come fanno le molecole con momenti di dipolo permanenti. Più voluminosa è la nuvola di elettroni, più difficile sarà il nucleo la manterrà omogenea nello spazio; e inoltre, maggiore è la deformazione di esso, come si può vedere in C.
Pertanto, gli atomi e le piccole molecole hanno meno probabilità di essere polarizzati da qualsiasi particella nel loro ambiente. Un esempio di questa situazione è illustrato dalla piccola molecola di idrogeno, HDue.
Perché si condensi, o anche di più, per cristallizzare, ha bisogno di pressioni esorbitanti per costringere le sue molecole a interagire fisicamente.
È inversamente proporzionale alla distanza
Sebbene si formino dipoli istantanei che inducono altri intorno a loro, non sono sufficienti per tenere insieme gli atomi o le molecole..
In B c'è una distanza d che separa le due nuvole e i loro due nuclei. In modo che entrambi i dipoli possano rimanere per un tempo considerato, questa distanza d deve essere molto piccolo.
Questa condizione, caratteristica essenziale delle forze londinesi (ricordiamo la chiusura in velcro), deve essere soddisfatta affinché abbia un effetto notevole sulle proprietà fisiche della materia..
Una volta d è piccolo, il nucleo a sinistra in B inizierà ad attrarre la regione blu δ dell'atomo o della molecola adiacente. Questo deformerà ulteriormente la nuvola, come si vede in C (il nucleo non è più al centro ma a destra). Poi, arriva un punto in cui entrambe le nuvole si toccano e "rimbalzano", ma abbastanza lente da tenerle insieme per un po '..
Pertanto, le forze di Londra sono inversamente proporzionali alla distanza d. In effetti, il fattore è uguale a d7, quindi una leggera variazione nella distanza tra i due atomi o molecole indebolirà o rafforzerà la diffusione di Londra.
È direttamente proporzionale alla massa molecolare
Come aumentare la dimensione delle nuvole in modo che si polarizzino più facilmente? Aggiungendo elettroni, e per questo il nucleo deve avere più protoni e neutroni, aumentando così la massa atomica; oppure, aggiungendo atomi alla spina dorsale della molecola, che a sua volta aumenterebbe la sua massa molecolare
In questo modo, i nuclei o lo scheletro molecolare avrebbero meno probabilità di mantenere la nuvola di elettroni sempre uniforme. Pertanto, più grandi sono i cerchi verdi considerati in A, B e C, più saranno polarizzabili e maggiori saranno anche le loro interazioni da parte delle forze di Londra..
Questo effetto è chiaramente osservato tra B e C, e potrebbe esserlo ancora di più se i cerchi avessero un diametro maggiore. Questo ragionamento è la chiave per spiegare le proprietà fisiche di molti composti in base alle loro masse molecolari..
Esempi di forze londinesi

In natura
Nella vita di tutti i giorni ci sono innumerevoli esempi delle forze di dispersione di Londra senza avventurarsi nel mondo microscopico in primo luogo..
Uno degli esempi più comuni e sorprendenti si trova nelle zampe di rettili conosciuti come gechi (immagine in alto) e in molti insetti (anche in Spiderman).
Sulle gambe hanno dei cuscinetti da cui sporgono migliaia di piccoli filamenti. Nell'immagine puoi vedere un geco in posa sul pendio di una roccia. Per ottenere ciò, si avvale delle forze intermolecolari tra la roccia e i filamenti delle sue gambe..
Ciascuno di questi filamenti interagisce debolmente con la superficie su cui si arrampica il piccolo rettile, ma poiché sono migliaia, esercitano una forza proporzionale all'area delle loro gambe, abbastanza forte da rimanere attaccati e possono arrampicarsi. I gechi sono anche in grado di arrampicarsi su superfici lisce e perfette come il vetro..
Alcani
Gli alcani sono idrocarburi saturi che interagiscono anche dalle forze di Londra. Le loro strutture molecolari sono costituite semplicemente da atomi di carbonio e idrogeni uniti da singoli legami. Poiché la differenza di elettronegatività tra C e H è molto piccola, sono composti apolari.
Quindi, metano, CH4, l'idrocarburo più piccolo di tutti, bolle a -161,7 ° C. Quando C e H vengono aggiunti allo scheletro, si ottengono altri alcani con masse molecolari più elevate.
In questo modo si formano etano (-88,6 ° C), butano (-0,5 ° C) e ottano (125,7 ° C). Nota come i loro punti di ebollizione aumentano man mano che gli alcani diventano più pesanti.
Questo perché le loro nuvole elettroniche sono più polarizzabili e le loro strutture hanno una superficie maggiore, il che aumenta il contatto tra le loro molecole..
L'ottano, sebbene sia un composto apolare, ha un punto di ebollizione più alto dell'acqua.
Alogeni e gas
Le forze di Londra sono presenti anche in molte sostanze gassose. Ad esempio, le molecole di NDue, HDue, CODue, FDue, ClDue e tutti i gas nobili, interagiscono attraverso queste forze, poiché presentano una distribuzione elettrostatica omogenea, che può subire dipoli istantanei e dare luogo a polarizzazioni.
I gas nobili sono He (elio), Ne (neon), Ar (argon), Kr (krypton), Xe (xenon) e Rn (radon). Da sinistra a destra, i loro punti di ebollizione aumentano con l'aumentare delle masse atomiche: -269, -246, -186, -152, -108 e -62 ºC.
Anche gli alogeni interagiscono attraverso queste forze. Il fluoro è un gas a temperatura ambiente proprio come il cloro. Il bromo, con una massa atomica maggiore, si trova in condizioni normali come un liquido rossastro, e lo iodio, infine, forma un solido violaceo che sublima rapidamente perché è più pesante degli altri alogeni.
Riferimenti
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). CENGAGE Learning, p 452-455.
- Angeles Mendez. (22 maggio 2012). Forze di dispersione (da Londra). Estratto da: quimica.laguia2000.com
- Forze di dispersione di Londra. Estratto da: chem.purdue.edu
- Helmenstine, Anne Marie, Ph.D. (22 giugno 2018). 3 tipi di forze intermolecolari. Estratto da: thoughtco.com
- Ryan Ilagan e Gary L Bertrand. Interazioni di dispersione di Londra. Tratto da: chem.libretexts.org
- Netorial di ChemPages. Forze di Londra. Estratto da: chem.wisc.edu
- Kamereon. (22 maggio 2013). Gechi: il geco e le forze di Van der Waals. Estratto da: almabiologica.com


Nessun utente ha ancora commentato questo articolo.