
Struttura, proprietà e usi del fluoruro di potassio (KF)
Il fluoruro di potassio È un alogenuro inorganico costituito da un sale formato tra il metallo e l'alogeno. La sua formula chimica è KF, il che significa che per ogni catione K+ c'è una F- controparte. Come si può vedere, le interazioni sono elettrostatiche e di conseguenza non ci sono legami K-F covalenti..
Questo sale si caratterizza per la sua estrema solubilità in acqua, motivo per cui forma idrata, assorbe l'umidità ed è deliquescente. Pertanto è molto facile prepararne soluzioni acquose, che fungono da fonte di anioni fluoruro per tutte quelle sintesi in cui si desidera incorporarlo in qualche struttura.
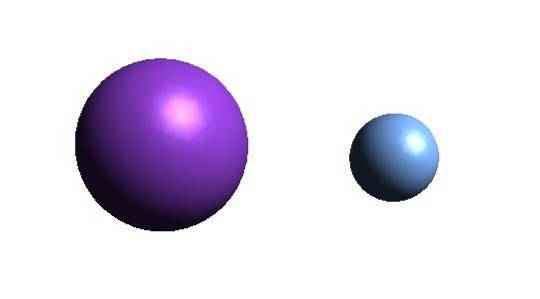
Sopra è il catione K+ (sfera viola) e l'anione F- (sfera bluastra). Entrambi gli ioni interagiscono attirandosi a vicenda con le loro cariche +1 e -1.
Sebbene KF non sia pericoloso come HF, il fatto che abbia l'anione F-, lo rende un sale tossico. Ecco perché le loro soluzioni sono state utilizzate come insetticidi.
KI è prodotto facendo reagire il carbonato di potassio con acido fluoridrico, producendo bifluoruro di potassio (KHFDue); che per decomposizione termica finisce per dare origine al fluoruro di potassio.
Indice articolo
- 1 Struttura del fluoruro di potassio
- 1.1 Idrata
- 2 Proprietà
- 2.1 Peso molecolare
- 2.2 Aspetto fisico (colore)
- 2.3 Aroma
- 2.4 Punto di ebollizione
- 2.5 Punto di fusione
- 2.6 Solubilità
- 2.7 Solubilità in acqua
- 2.8 Densità
- 2.9 Pressione di vapore
- 2.10 Decomposizione
- 2.11 Azione corrosiva
- 2.12 Punto di infiammabilità
- 2.13 Indice di rifrazione sperimentale (ηD)
- 2.14 Stabilità
- 3 usi
- 3.1 Regolare il pH
- 3.2 Fonte di fluoro
- 3.3 Sintesi di fluorocarburi
- 3.4 Fluorurazione
- 3.5 Varie
- 4 Riferimenti
Struttura del fluoruro di potassio
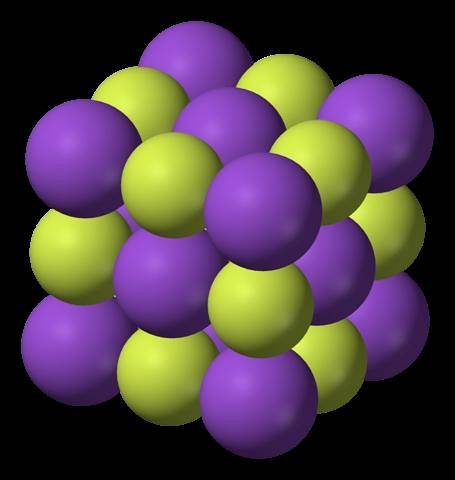
L'immagine in alto mostra la struttura del fluoruro di potassio. Le sfere viola, come nella prima immagine, rappresentano i cationi K.+; mentre le sfere giallastre rappresentano gli anioni F-.
Si noti che la disposizione è cubica e corrisponde a una struttura simile al salgemma, molto simile a quella del cloruro di sodio. Tutte le sfere sono circondate da sei vicini, che compongono un ottaedro KF6 o FK6; cioè, ogni K+ si circonda di sei F-, e lo stesso accade viceversa.
È stato accennato in precedenza che KF è igroscopico e quindi assorbe l'umidità dall'ambiente. Stando così le cose, la disposizione mostrata corrisponderebbe alla forma anidra (senza acqua) e non ai suoi idrati; che assorbono così tanta acqua che si solubilizzano e si "sciolgono" (deliquescenza).
Idrata
Le strutture cristalline degli idrati diventano meno semplici. Perché? Perché ora le molecole d'acqua intervengono direttamente negli arrangiamenti e interagiscono con gli ioni K.+ e F-. Uno degli idrati più stabili è KF2HDueO e KF 4HDueO.
In entrambi gli idrati gli ottaedri appena citati sono deformati dalle molecole d'acqua. Ciò è dovuto principalmente ai legami idrogeno tra F- e l'HDueO (F--HOH). Studi cristallografici hanno stabilito che nonostante ciò i due ioni continuano ad avere lo stesso numero di vicini.
Come risultato di tutto ciò, la struttura cubica originale del fluoruro di potassio anidro diventa una disposizione monoclina e persino romboedrica..
Quelli anidri condividono la proprietà deliquescente, quindi i loro cristalli bianchi, se lasciati a contatto con una nebbia fredda, diventerebbero acquosi in breve tempo..
Proprietà
Peso molecolare
58.097 g / mol.
Aspetto fisico (colore)
Cristalli cubici bianchi o polvere cristallina bianca deliquescente.
Gusto
Sapore salato deciso.
Punto di ebollizione
Da 2,741 ° F a 760 mmHg (1502 ° C). Allo stato liquido diventa un conduttore di elettricità, sebbene gli anioni F- non collaborare allo stesso grado della K+.
Punto di fusione
1.576 ° F; 858 ° C; 1131 K (KF anidro). Questo è indicativo dei suoi forti legami ionici..
Solubilità
Solubile in HF, ma insolubile in alcool. Ciò mostra che i legami idrogeno tra fluoruro e alcoli, F--HOR, non favorire il processo di solvatazione contro la dissoluzione del suo reticolo cristallino.
Solubilità dell'acqua
92 g / 100 ml anidro (18 ° C); 102 g / 100 ml (25 ° C); diidrato 349,3 g / 100 ml (18 ° C). Cioè, poiché KF è idratato, diventa più solubile in acqua..
Densità
2,48 g / cm3.
Pressione del vapore
100 kPa (750 mmHg) a 1.499 ºC.
Decomposizione
Quando riscaldato fino alla decomposizione, emette un fumo tossico di ossido di potassio e acido fluoridrico..
Azione corrosiva
Una soluzione acquosa corrode il vetro e la porcellana.
Punto d'infiammabilità
Non è una sostanza infiammabile
Indice di rifrazione sperimentale (ηD)
1.363.
Stabilità
Stabile se protetto dall'umidità, altrimenti il solido si dissolverà. Incompatibile con acidi e basi forti.
Applicazioni
Regola il pH
Le soluzioni acquose di fluoruro di potassio sono utilizzate in applicazioni e processi industriali; Ad esempio, le soluzioni KF consentono di regolare il pH nella produzione negli impianti di lavorazione tessile e nelle lavanderie (lo approssimano a un valore di 7).
Fonte di fluoro
Il fluoruro di potassio è dopo il fluoruro di idrogeno, la principale fonte per ottenere il fluoro. Questo elemento è utilizzato negli impianti nucleari e nella produzione di composti inorganici e organici, alcuni con usi come la sua incorporazione nei dentifrici..
Sintesi di fluorocarburi
Il fluoruro di potassio può essere utilizzato nella sintesi di fluorocarbon o fluorocarbon da clorocarbon, utilizzando la reazione Finkeistein. Il glicole etilenico e il dimetilsolfossido sono usati come solventi in questa reazione..
Fluorurazione
Poiché è una fonte di fluoro dove si trova disciolto in acqua, dalle sue soluzioni possono essere sintetizzati fluoruri complessi; cioè, viene aggiunta una F a loro- alle strutture. Un esempio è nella seguente equazione chimica:
MnBrDue(ac) + 3KF (ac) => KMnF3(i) + 2KBr (ac)
KMnF fluoruro misto quindi precipita3. Quindi, F- in modo che faccia parte di un sale metallico complesso. Oltre al manganese, possono essere precipitati fluoruri di altri metalli: KCoF3, KFeF3, KNiF3, KCuF3 e KZnF3.
Allo stesso modo, il fluoro può essere incorporato in modo covalente in un anello aromatico, sintetizzando organofluoruri.
Varie
Il KF viene utilizzato come intermedio o materia prima per la sintesi di composti che vengono utilizzati principalmente nei prodotti agrochimici o nei prodotti antiparassitari..
Inoltre, viene utilizzato come fondente per saldature e nell'incisione del vetro; ovvero, la sua soluzione acquosa consuma la superficie del vetro e, su uno stampo, stampa la finitura desiderata.
Riferimenti
- Libro chimico. (2017). Fluoruro di potassio. Estratto da: chemicalbook.com
- PubChem. (2019). Fluoruro di potassio. Estratto da: pubchem.ncbi.nlm.nih.gov
- T. H. Anderson e E. C. Lincafelte. (1951). La struttura del fluoruro di potassio diidrato. Acta Cryst. 4, 181.
- Royal Society of Chemistry. (2015). Fluoruro di potassio. ChemSpider. Estratto da: chemspider.com
- Maquimex. (s.f.). Fluoruro di potassio. Estratto da: maquimex.com



Nessun utente ha ancora commentato questo articolo.