
Fattore di compressibilità come calcolare, esempi ed esercizi
Il fattore di compressibilità Z, o fattore di compressione per i gas, è un valore adimensionale (senza unità) introdotto come correzione nell'equazione di stato dei gas ideali. In questo modo, il modello matematico assomiglia più da vicino al comportamento osservato del gas..
Nel gas ideale l'equazione di stato relativa alle variabili P (pressione), V (volume) e T (temperatura) è: P.V ideale = n.R.T con n = numero di moli e R = costante del gas ideale. Aggiungendo la correzione per il fattore di compressibilità Z, questa equazione diventa:
P.V = Z.n.R.T
Indice articolo
- 1 Come calcolare il fattore di compressibilità?
- 2 esempi
- 2.1 Il fattore di compressibilità in gas ideali, aria, idrogeno e acqua
- 3 esercizi risolti
- 3.1 Esercizio 1
- 3.2 Esercizio 2
- 4 Riferimenti
Come calcolare il fattore di compressibilità?
Tenendo conto che il volume molare è Vfreddo = V / n, abbiamo il volume molare reale:
P . Vvero = Z. R. T → Z = PV vero/ RT
Poiché il fattore di compressibilità Z dipende dalle condizioni del gas, è espresso in funzione della pressione e della temperatura:
Z = Z (P, T)
Confrontando le prime due equazioni, si può vedere che se il numero di moli n è uguale a 1, il volume molare di un gas reale è correlato a quello del gas ideale da:
Vvero / Videale = Z → V vero = Z Videale
Quando la pressione supera le 3 atmosfere, la maggior parte dei gas smette di comportarsi come gas ideali e il volume reale differisce in modo significativo dall'ideale.
Ciò fu realizzato nei suoi esperimenti dal fisico olandese Johannes Van der Waals (1837-1923), che lo portò a creare un modello più adatto ai risultati pratici dell'equazione dei gas ideali: l'equazione di stato di Van der Waals..
Esempi
Secondo l'equazione P.Vvero= Z.n.RT, Per un gas ideale, Z = 1. Tuttavia, nei gas reali, all'aumentare della pressione, aumenta anche il valore di Z. Questo ha senso perché maggiore è la pressione le molecole di gas hanno maggiori possibilità di scontrarsi, quindi le forze repulsive aumentano con esso il volume.
D'altra parte, a pressioni inferiori, le molecole si muovono più liberamente e le forze repulsive diminuiscono. Pertanto è previsto un volume inferiore. Per quanto riguarda la temperatura, quando aumenta, Z diminuisce.
Come ha osservato Van der Waals, in prossimità del cosiddetto punto critico, il comportamento del gas si discosta notevolmente da quello di un gas ideale..
Il punto critico (Tc, Pc) di qualsiasi sostanza sono i valori di pressione e temperatura che determinano il suo comportamento prima di un cambiamento di fase:
-Tc è la temperatura al di sopra della quale il gas in questione non si liquefa.
-Pc è la pressione minima richiesta per liquefare il gas alla temperatura Tc
Ogni gas ha però un proprio punto critico che definisce la temperatura e la pressione ridotta Tr E pr come segue:
Pr = P / Pc
Vr = V / Vc
Tr = T / Tc
Si osserva che un gas confinato con identico Vr Y Tr esercita la stessa pressione Pr. Per questo motivo, se Z viene tracciato in funzione di Pr a se stessi Tr, ogni punto su quella curva è lo stesso per qualsiasi gas. Questo è chiamato principio degli stati corrispondenti.
Il fattore di compressibilità in gas ideali, aria, idrogeno e acqua
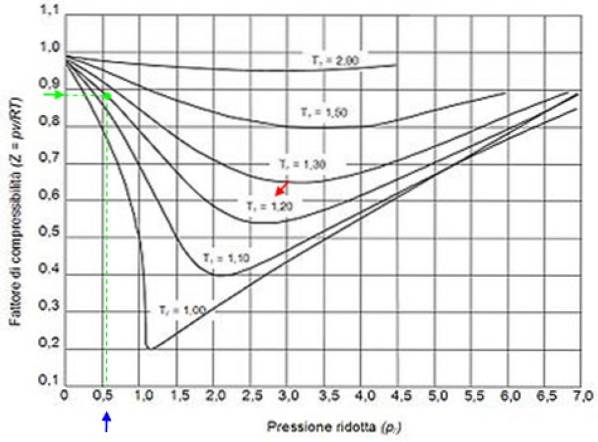
Di seguito è riportata una curva di compressibilità per vari gas a varie temperature ridotte. Di seguito sono riportati alcuni esempi di Z per alcuni gas e una procedura per trovare Z utilizzando la curva.
Gas ideali
I gas ideali hanno Z = 1, come spiegato all'inizio.
Aria
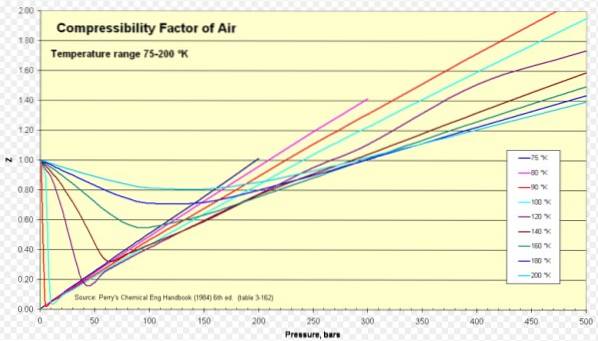
Per l'aria Z è circa 1 in un'ampia gamma di temperature e pressioni (vedi figura 1), dove il modello di gas ideale dà ottimi risultati.
Idrogeno
Z> 1 per tutte le pressioni.
acqua
Per trovare Z per l'acqua, sono necessari i valori dei punti critici. Il punto critico dell'acqua è: Pc = 22,09 MPa e Tc= 374,14 ° C (647,3 K). Anche in questo caso, si deve tenere conto del fatto che il fattore di compressibilità Z dipende dalla temperatura e dalla pressione..
Ad esempio, supponiamo di voler trovare Z di acqua a 500 ºC e 12 MPa. Quindi la prima cosa da fare è calcolare la temperatura ridotta, per la quale i gradi Celsius devono essere convertiti in Kelvin: 50 ºC = 773 K:
Tr = 773 / 647,3 = 1,2
Pr = 12 / 22,09 = 0,54
Con questi valori posizioniamo nel grafico della figura la curva corrispondente a Tr = 1.2, indicato da una freccia rossa. Successivamente cerchiamo il valore di P sull'asse orizzontaler più vicino a 0,54, contrassegnato in blu. Ora disegniamo una verticale fino a quando non intercettiamo la curva Tr = 1.2 e infine si proietta da quel punto all'asse verticale, dove si legge il valore approssimativo di Z = 0.89.
Esercizi risolti
Esercizio 1
Esiste un campione di gas alla temperatura di 350 K e alla pressione di 12 atmosfere, con un volume molare del 12% superiore a quello previsto dalla legge dei gas ideali. Calcolare:
a) Fattore di compressione Z.
b) Volume molare di gas.
c) Secondo i risultati precedenti, indicare quali sono le forze dominanti in questo campione di gas.
Dati: R = 0,082 L.atm / mol.K
Soluzione a
Sapendo che V vero è del 12% maggiore di Videale :
Vvero = 1,12 V.ideale
Z = V vero / Videale = 1,12
Soluzione b
P. Vvero = Z. R. T → Vvero = (1,12 x 0,082 x 350/12) L / mol = 2,14 L / mol.
Soluzione c
Le forze repulsive sono quelle predominanti, poiché il volume del campione è aumentato.
Esercizio 2
Ci sono 10 moli di etano confinate in un volume di 4,86 L a 27 ºC. Trova la pressione esercitata dall'etano da:
a) Il modello del gas ideale
b) L'equazione di van der Waals
c) Trova il fattore di compressione dai risultati precedenti.
Dati per etano
Coefficienti di Van der Waals:
a = 5.489 dm6. ATM. Talpa-Due e b = 0,06380 dm3. Talpa-1.
Pressione critica: 49 atm. Temperatura critica: 305 K
Soluzione a
La temperatura è passata al kelvin: 27 º C = 27 +273 K = 300 K, ricorda anche che 1 litro = 1 L = 1 dm3.
Quindi i dati forniti vengono sostituiti nell'equazione del gas ideale:
P.V = n.R.T → P = (10 x 0,082 x 300 / 4,86 L) atm = 50,6 atm
Soluzione b
L'equazione di stato di Van der Waals è:
Dove aeb sono i coefficienti forniti dall'istruzione. Quando si cancella P:
Soluzione c
Calcoliamo la pressione e la temperatura ridotte:
Pr = 35,2 / 49 = 0,72
Tr = 300/305 = 0,98 ≈ 1
Con questi valori cerchiamo il valore di Z nel grafico della figura 2, trovando che Z è approssimativamente 0,7.
Riferimenti
- Atkins, P. 1999. Chimica fisica. Edizioni Omega.
- Cengel, Y. 2012. Termodinamica. 7ma Edizione. Mcgraw hill.
- Engel, T. 2007. Introduzione alla Fisicochimica: Termodinamica. Pearson.
- Levine, I. 2014. Principles of Physico-chemistry. 6 °. Edizione. Mcgraw hill.
- Wikipedia. Fattore di compressibilità. Estratto da: en.wikipedia.org.


Nessun utente ha ancora commentato questo articolo.