
Esame delle feci, campionamento, tecniche, esempi
Il esame delle feci è uno studio di laboratorio in cui viene esaminata la materia fecale (feci) per rilevare i parassiti intestinali. È una delle tecniche di laboratorio più semplici e antiche, sviluppata inizialmente da Anton Van Leeuwenhoek nel XVIII secolo..
Anton Van Leeuwenhoek, considerato il padre della microbiologia, usò il metodo coproparassitico-toscopico "diretto" per osservare le proprie feci e descrisse quelli che anni dopo furono identificati come i trofozoiti di giardia lamblia "non e 'Inglese, un protozoo che invade l'intestino tenue dell'uomo.
Le malattie parassitarie colpiscono milioni di persone nel mondo, soprattutto nei paesi poveri o sottosviluppati, dove esistono cattive condizioni igienico-sanitarie legate allo smaltimento degli escrementi e al consumo di acqua contaminata..
La diagnosi di queste malattie è importante per una cura adeguata, essendo l'esame coproparassitoscopico uno strumento indispensabile per essa. È un test di laboratorio semplice, veloce ed economico.
L'esame delle feci comprende diverse tecniche che, oltre a consentire la visualizzazione e la quantificazione diretta di uova, trofozoiti, cisti o larve, consentono di identificare le strutture del microrganismo e quindi identificare il parassita..
Le tecniche utilizzate per l'esame delle feci includono tecniche di colorazione con blu di metilene, metodi di concentrazione, tecnica Faust, Richie, tecniche di sedimentazione ed esami diretti, singoli o seriali..
Indice articolo
- 1 Raccolta di campioni
- 2 Tecniche
- 2.1 Esami diretti
- 2.2 Sospensione e tecniche di concentrazione
- 3 esempi
- 4 Riferimenti
Campionamento
Per eseguire questo studio, il paziente deve prelevare un campione di feci fresco che non sia contaminato da urina, acqua, sangue (mestruale) o suolo. Il campione deve avere le dimensioni di una noce o, se è liquido, deve essere almeno del volume corrispondente a due cucchiai.
Il paziente non deve aver assunto farmaci parassiticidi per almeno tre giorni prima del prelievo del campione o per il periodo indicato dal proprio medico. Inoltre, non dovresti usare farmaci lassativi.
I campioni devono essere collocati in un contenitore asciutto, a bocca larga, con coperchio o in un contenitore monouso appositamente progettato (disponibile presso la farmacia preferita). I campioni devono essere collocati in un ambiente fresco, non devono essere refrigerati per più di 24 ore e non devono essere conservati vicino a fonti di calore o congelati.
Quando l'esame indicato è seriale, sono richiesti almeno tre campioni, che devono essere prelevati ogni 24 ore o più, come indicato dal medico. Per questi casi, i laboratori generalmente forniscono una serie di flaconi contenenti soluzioni con conservanti..
Quando il paziente osserva un "verme" nelle feci, se possibile, deve metterlo in una bottiglia chiusa con acqua e portarlo in laboratorio insieme alla bottiglia del campione di feci..
Le fiale con i campioni o con i "vermi" devono essere etichettate e identificate con il nome del paziente, la sua età, il sesso e la data e l'ora della raccolta del campione..
È molto importante istruire adeguatamente il paziente su tutti questi aspetti del prelievo e della manipolazione dei campioni, poiché dipende dal fatto che gli elementi che possono esistere in detto campione rimangano vitali per l'osservazione, l'identificazione e la diagnosi..
Tecniche
Esistono test diretti delle feci e tecniche di sospensione e concentrazione dei campioni che vengono utilizzate molte volte per evitare falsi negativi e osservare campioni molto più puliti. Alcune tecniche di colorazione vengono utilizzate anche per identificare alcuni parassiti..
Esami diretti
L'esame delle feci diretto, con la tecnica del orecchino a goccia, consiste nel diluire il campione di feci con soluzione fisiologica (0,9% NaCl) e posizionare una goccia di questa soluzione in una concavità che ha un apposito vetrino utilizzato a tale scopo.
Una volta che la goccia viene posizionata sul vetrino, viene coperta con un vetrino e osservata al microscopio. Questa tecnica ci permette di osservare uova e cisti, ma ci permette anche di osservare qualsiasi elemento mobile come flagellati, larve, trofozoiti, ciliati, ecc..
Tecniche di sospensione e concentrazione
Le tecniche di sospensione utilizzano una soluzione più densa degli elementi da osservare, in modo che questi galleggino sulla superficie del liquido e possano essere raccolti, poiché rimangono concentrati nello strato superficiale della soluzione..
Questa tecnica ha il vantaggio che permette di avere un campione di detriti abbastanza pulito, poiché questi, essendo più densi, rimangono sul fondo della bottiglia. Lo svantaggio relativo è che la soluzione si restringe e deforma i microrganismi in breve tempo.
Questi metodi non sono usati per le uova di elminti e cestodi perché sono molto pesanti e non galleggiano in queste soluzioni. Sono ampiamente utilizzati per osservare i protozoi nella loro forma tropozoica o le loro uova e per l'osservazione di larve come quelle di Strongyloides stercoralis.
Un'altra tecnica molto utilizzata perché non deforma i microrganismi presenti nel campione ed è semplice ed economica è la tecnica di sedimentazione in formalina..
Tra le tecniche di concentrazione possiamo citare come esempio le tecniche di Faust e Richie.
Le diverse tecniche che consentono la visualizzazione microscopica delle uova, delle larve o di altri elementi dei diversi parassiti intestinali, unite alle tecniche di colorazione, consentono l'identificazione e la diagnosi di queste malattie..
Esempi
Successivamente, viene descritto un caso clinico e vengono mostrate alcune immagini che illustrano l'utilità dell'esame delle feci per la diagnosi e la valutazione dei benefici del trattamento..
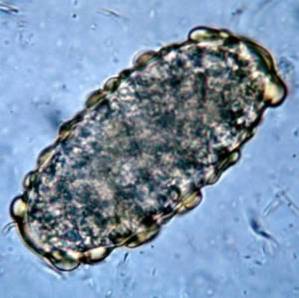
Un paziente maschio di 18 anni si presenta in ambulatorio per dolori addominali colici, più intensi nella zona periombelicale, nausea ed episodi di diarrea acquosa.
Nell'interrogare il paziente, il medico nota due punti salienti: 1) il paziente si riferisce di aver fatto il bagno in un lago in una zona rurale e 2) è colpito dal fatto che le sue feci galleggino nella toilette. Dopo aver esaminato il paziente, il medico sospetta la presenza di giardia lamblia "non e 'Inglese.
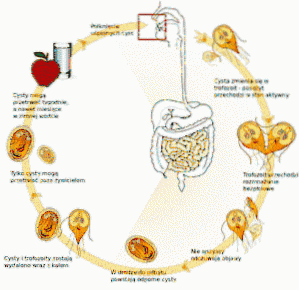
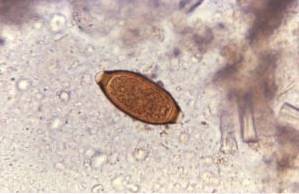
Questo protozoo vive nell'intestino tenue dell'uomo e interferisce con l'assorbimento dei grassi, che genera feci molto unte che tendono a galleggiare. L'inquinamento si verifica frequentemente da acqua inquinata in laghi o torrenti nelle zone rurali o in piscine o vasche idromassaggio con scarsa manutenzione.
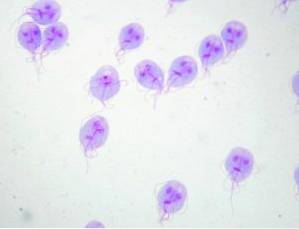
Il medico indica un esame delle feci ei risultati confermano la presenza di giardia lamblia "non e 'Inglese. Dopo la fine del trattamento, viene indicato un altro esame delle feci che conferma l'assenza di cisti o trofozoiti di giardia lamblia "non e 'Inglese.
Riferimenti
- Buonfrate, D., Mena, M. A., Angheben, A., Requena-Mendez, A., Muñoz, J., Gobbi, F.,… & COHEMI Project Study Group. (2015). Prevalenza della strongiloidiasi in America Latina: una revisione sistematica della letteratura. Epidemiologia e infezione, 143(3), 452-460.
- de Haro Arteaga, I., & Ruiz, A. E. C. (2014). Diagnosi di. Parassitologia medica (4 °, 347.
- Mendoza, D., Nunez, F. A., Escobedo, A. A., Pelayo, L., Fernandez, M., Torres, D., & Cordovi, R. A. (2003). Utilità di 2 metodi coproparassitologici e loro utilizzo in una sperimentazione terapeutica antigiardiasi. Giornale cubano di medicina tropicale, 55(3), 174-178.
- Prezzo, -D. L. (2017). Manuale di procedura per la diagnosi dei parassiti intestinali. CRC Press.
- Sahin, I., Kiliç, H., Ozca, M. e Orhan, R. (1984). Uno studio coproparassitologico sui lottatori della nazionale. Mikrobiyoloji bülteni, 18(2), 114-118.


Nessun utente ha ancora commentato questo articolo.