
Caratteristiche dello stato solido, proprietà, tipi, esempi

Il stato solido è uno dei modi principali in cui la materia viene aggiunta per creare corpi condensati o solidi. L'intera crosta terrestre, esclusi i mari e gli oceani, è un variegato conglomerato di solidi. Esempi di oggetti allo stato solido sono un libro, una pietra o granelli di sabbia.
Possiamo interagire con i solidi grazie alla repulsione dei nostri elettroni con quelli dei loro atomi o molecole. A differenza di liquidi e gas, purché non siano gravemente tossici, le nostre mani non possono attraversarli, ma sbriciolarli o assorbirli.

I solidi sono generalmente molto più facili da maneggiare o immagazzinare rispetto a un liquido o un gas. A meno che le sue particelle non siano finemente suddivise, una corrente del vento non lo trasporterà in altre direzioni; sono fissati nello spazio definito dalle interazioni intermolecolari dei loro atomi, ioni o molecole.
Indice articolo
- 1 Concetto di solido
- 2 Caratteristiche generali dei solidi
- 3 Proprietà
- 3.1 Punti di fusione
- 3.2 Stechiometria
- 3.3 Difetti
- 3.4 Reattività
- 3.5 Fisico
- 4 Tipi ed esempi
- 4.1 Solidi cristallini
- 4.2 Solidi amorfi
- 4.3 Ionico
- 4.4 Metallico
- 4.5 Atomico
- 4.6 Molecolare e polimero
- 4.7 Reti covalenti
- 5 Riferimenti
Concetto solido
Il solido è uno stato della materia in cui c'è un volume e una forma rigidi; le particelle che formano materiali o oggetti allo stato solido sono fissate in un punto, non sono facilmente comprimibili.
Questo stato della materia è il più vario e ricco dal punto di vista chimico e fisico. Abbiamo solidi ionici, metallici, atomici, molecolari e covalenti, ciascuno con la propria unità strutturale; cioè con i suoi cristalli. Quando il loro modo di aggregazione non consente loro di stabilire strutture interne ordinate, diventano amorfe e intricate.
Lo studio dello stato solido converge nella progettazione e sintesi di nuovi materiali. Ad esempio, il legno, un solido naturale, è stato utilizzato anche come materiale ornamentale e per la costruzione di case.
Altri materiali solidi consentono la fabbricazione di automobili, aeroplani, navi, astronavi, reattori nucleari, articoli sportivi, batterie, catalizzatori e molti altri oggetti o prodotti..
Caratteristiche generali dei solidi

Le caratteristiche principali dei solidi sono:
-Hanno massa, volume e forme definiti. Un gas, ad esempio, non ha una fine né un inizio, poiché questi dipendono dal contenitore che lo immagazzina..
-Sono molto densi. I solidi tendono ad essere più densi dei liquidi e dei gas; sebbene ci siano alcune eccezioni alla regola, soprattutto quando si confrontano liquidi e solidi.
-Le distanze che separano le loro particelle sono brevi. Ciò significa che sono stati molto coesi o compattati nel rispettivo volume.

-Le loro interazioni intermolecolari sono molto forti, altrimenti non esisterebbero come tali e si scioglierebbero o sublimerebbero in condizioni terrestri..

-La mobilità dei solidi è solitamente piuttosto limitata, non solo da un punto di vista materiale, ma anche da un punto di vista molecolare. Le sue particelle sono confinate in una posizione fissa, dove possono solo vibrare, ma non muoversi o ruotare (in teoria).
Proprietà
Punti di fusione
Tutti i solidi, a meno che non si decompongano durante il processo e indipendentemente dal fatto che siano o meno buoni conduttori di calore, possono passare allo stato liquido a una certa temperatura: il loro punto di fusione. Quando viene raggiunta questa temperatura, le sue particelle riescono finalmente a fluire e fuoriuscire dalle loro posizioni fisse..
Questo punto di fusione dipenderà dalla natura del solido, dalle sue interazioni, dalla massa molare e dall'energia del reticolo cristallino. Come regola generale, i solidi ionici e le reti covalenti (come il diamante e il biossido di silicio) tendono ad avere i punti di fusione più elevati; mentre i solidi molecolari, i più bassi.
L'immagine seguente mostra come un cubetto di ghiaccio (stato solido) si trasforma in uno stato liquido:

Stechiometria
Gran parte dei solidi sono molecolari, poiché sono composti le cui interazioni intermolecolari consentono loro di fondersi in questo modo. Tuttavia, molti altri sono ionici o parzialmente ionici, quindi le loro unità non sono molecole, ma cellule: un insieme di atomi o ioni disposti in modo ordinato..
È qui che le formule di tali solidi devono rispettare la neutralità delle cariche, indicandone la composizione e le relazioni stechiometriche. Ad esempio, il solido la cui formula ipotetica è ADueB4ODue fa notare che ha lo stesso numero di atomi A di O (2: 2), mentre ha il doppio del numero di atomi B (2: 4).
Nota che i pedici della formula ADueB4ODue sono numeri interi, il che mostra che si tratta di un solido stechiometrico. La composizione di molti solidi è descritta da queste formule. Le cariche di A, B e O devono sommarsi pari a zero, perché altrimenti ci sarebbe una carica positiva o negativa.
Per i solidi è particolarmente utile saper interpretare le loro formule poiché, generalmente, le composizioni di liquidi e gas sono più semplici.
Difetti
Le strutture dei solidi non sono perfette; presentano imperfezioni o difetti, per quanto cristallini possano essere. Questo non è il caso di liquidi o gas. Non ci sono regioni di acqua liquida che si possa affermare in anticipo che siano "dislocate" rispetto all'ambiente circostante..
Tali difetti sono responsabili del fatto che i solidi sono duri e fragili, mostrando proprietà come piroelettricità e piezoelettricità, o cessando di avere composizioni definite; cioè, sono solidi non stechiometrici (ad esempio, A0.4B1.3O0,5).
Reattività
I solidi sono generalmente meno reattivi dei liquidi e dei gas; ma non per cause chimiche, ma per il fatto che le loro strutture impediscono ai reagenti di attaccare le particelle al loro interno, reagendo prima con quelle sulla loro superficie. Pertanto, le reazioni che coinvolgono i solidi tendono ad essere più lente; a meno che non siano polverizzati.
Quando un solido è in polvere, le sue particelle più piccole hanno un'area o una superficie maggiore per reagire. Questo è il motivo per cui i solidi fini sono spesso etichettati come reagenti potenzialmente pericolosi, poiché possono infiammarsi rapidamente o reagire vigorosamente a contatto con altre sostanze o composti..
I solidi vengono spesso disciolti in un mezzo di reazione per omogeneizzare il sistema ed effettuare una sintesi con resa maggiore..
Fisico
Ad eccezione del punto di fusione e dei difetti, quanto detto finora corrisponde più alle proprietà chimiche dei solidi che alle loro proprietà fisiche. La fisica dei materiali è profondamente focalizzata su come la luce, il suono, gli elettroni e il calore interagiscono con i solidi, siano essi cristallini, amorfi, molecolari, ecc..
È qui che entrano in gioco i cosiddetti solidi plastici, elastici, rigidi, opachi, trasparenti, superconduttori, fotoelettrici, microporosi, ferromagnetici, isolanti o semiconduttori..
In chimica, ad esempio, sono interessanti i materiali che non assorbono la radiazione ultravioletta o la luce visibile, poiché vengono utilizzati per realizzare celle di misura per spettrofotometri UV-Vis. Lo stesso accade con la radiazione infrarossa, quando si vuole caratterizzare un composto ricavandone lo spettro IR, oppure studiare l'andamento di una reazione.
Lo studio e la manipolazione di tutte le proprietà fisiche dei solidi richiede un'enorme dedizione, così come la loro sintesi e progettazione, scegliendo "pezzi" di costruzione inorganica, biologica, organica o organometallica per nuovi materiali.
Tipi ed esempi
Poiché ci sono diversi tipi di solidi chimicamente, esempi rappresentativi verranno menzionati separatamente per ciascuno..
Solidi cristallini
Da un lato, ci sono solidi cristallini. Questi elementi sono caratterizzati perché le molecole che li compongono sono configurate nello stesso modo, che si ripete come uno schema in tutto il cristallo. Ogni modello è chiamato cella unitaria.
I solidi cristallini sono anche caratterizzati dall'avere un punto di fusione definito; Ciò significa che, data l'uniformità della disposizione delle sue molecole, c'è la stessa distanza tra ogni cella unitaria, che permette all'intera struttura di trasformarsi costantemente alla stessa temperatura..
Esempi di solidi cristallini possono essere sale e zucchero..
Solidi amorfi
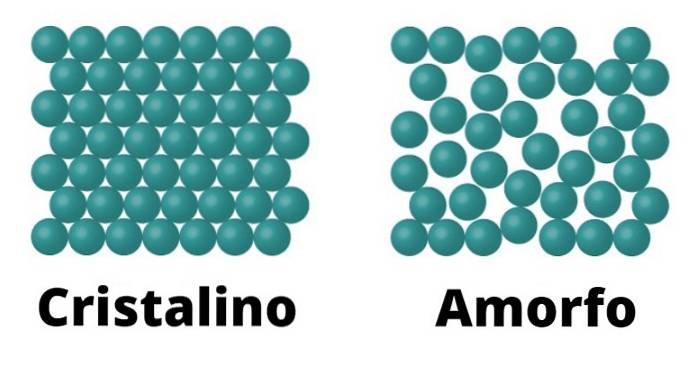
I solidi amorfi sono caratterizzati perché la conformazione delle loro molecole non risponde a uno schema, ma piuttosto varia su tutta la superficie.
Poiché non esiste tale modello, il punto di fusione dei solidi amorfi non è definito, a differenza di quelli cristallini, il che significa che si scioglie gradualmente ea temperature diverse..
Esempi di solidi amorfi possono essere il vetro e la maggior parte delle materie plastiche.
Ionica
I solidi ionici sono caratterizzati dall'avere cationi e anioni, che interagiscono tra loro per attrazione elettrostatica (legame ionico). Quando gli ioni sono piccoli, le strutture risultanti sono solitamente sempre cristalline (tenendo conto dei loro difetti). Tra alcuni solidi ionici abbiamo:
-NaCl (Na+Cl-), cloruro di sodio
-MgO (MgDue+ODue-), ossido di magnesio
-Ladro3 (ACDue+CO3Due-), carbonato di calcio
-CORSO4 (CuDue+SW4Due-), solfato di rame
-KF (K+F-), fluoruro di potassio
-NH4Cl (NH4+Cl-), cloruro d'ammonio
-ZnS (ZnDue+SDue-), solfuro di zinco
-Fe (C6H5COO)3, benzoato di ferro
Metallico
Come indica il loro nome, sono solidi che hanno atomi metallici che interagiscono attraverso il legame metallico:
-Argento
-Oro
-Condurre
-Ottone
-Bronzo
-oro bianco
-Peltro
-Acciai
-Duralluminio
Si noti che le leghe contano anche come solidi metallici, evidentemente.
Atomico
Anche i solidi metallici sono atomici, poiché in teoria non ci sono legami covalenti tra gli atomi metallici (M-M). Tuttavia, i gas nobili contano essenzialmente come specie atomiche, poiché tra loro predominano solo le forze dispersive di Londra..
Pertanto, sebbene non siano solidi ad alta applicazione (e difficili da ottenere), i gas nobili cristallizzati sono esempi di solidi atomici; cioè: elio, neon, argon, krypton, ecc., solidi.
Molecolare e polimero
Le molecole possono interagire attraverso le forze di Van der Walls, dove le loro masse molecolari, i momenti di dipolo, i legami idrogeno, le strutture e le geometrie giocano un ruolo importante. Più forti sono queste interazioni, più è probabile che abbiano la forma di un solido.
D'altra parte, lo stesso ragionamento vale per i polimeri, che a causa delle loro masse molecolari medie elevate sono quasi sempre solidi, e molti di loro sono amorfi; poiché le sue unità polimeriche hanno difficoltà a disporsi per creare cristalli.
Quindi, tra alcuni solidi molecolari e polimerici abbiamo quanto segue:
-Ghiaccio secco

-zucchero
-Iodio
-Acido benzoico
-Acetamide
-Zolfo rombico
-Acido palmitico
-Fullereni
-Incontro
-Caffeina
-Naftalene
-Legno e carta
-Seta
-Teflon
-Polietilene
-Kevlar
-Bachelite
-Cloruro di polivinile
-Polistirolo
-Polipropilene
-Proteina
-Barretta di cioccolato
Reti covalenti
Infine, abbiamo le reti covalenti tra i solidi più duri e quelli a più alto punto di fusione. Alcuni esempi sono:
-Grafite
-Diamante
-Quarzo
-Carburo di silicio
-Nitruro di boro
-Fosfuro di alluminio
-Arseniuro di gallio
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Wikipedia. (2019). Chimica allo stato solido. Estratto da: en.wikipedia.org
- Elsevier B.V. (2019). Chimica dello stato solido. ScienceDirect. Estratto da: sciencedirect.com
- Dr. Michael Lufaso. (s.f.). Appunti delle lezioni di chimica allo stato solido. Recupero da: unf.edu
- askIITians. (2019). Caratteristiche generali dello stato solido. Estratto da: askiitians.com
- David Wood. (2019). Come gli atomi e le molecole formano i solidi: modelli e cristalli. Studia. Estratto da: study.com



Nessun utente ha ancora commentato questo articolo.