
Espressione della concentrazione chimica, unità, molalità

Il concentrazione chimica è la misura numerica della quantità relativa di soluto in una soluzione. Questa misura esprime un rapporto tra il soluto e una quantità o un volume del solvente o della soluzione in unità di concentrazione. Il termine "concentrazione" è correlato alla quantità di soluto presente: una soluzione sarà tanto più concentrata quanto più soluto avrà.
Queste unità possono essere fisiche quando si tiene conto delle grandezze di massa e / o volume della soluzione o dei componenti chimici, quando la concentrazione del soluto è espressa in termini di moli o equivalenti, prendendo come riferimento il numero di Avogadro..

Pertanto, utilizzando pesi molecolari o atomici e il numero di Avogadro, è possibile convertire unità fisiche in unità chimiche quando si esprime la concentrazione di un dato soluto. Pertanto, tutte le unità possono essere convertite per la stessa soluzione.
Indice articolo
- 1 Soluzioni diluite e concentrate
- 2 modi per esprimere la concentrazione
- 2.1 Descrizione qualitativa
- 2.2 Classificazione per solubilità
- 2.3 Notazione quantitativa
- 3 unità di concentrazione
- 3.1 Unità di concentrazione relativa
- 3.2 Unità di concentrazione diluita
- 3.3 Unità di concentrazione in funzione delle moli
- 3.4 Formalità e normalità
- 4 Molarità
- 4.1 Esercizio 1
- 4.2 Esercizio 2
- 5 Normalità
- 5.1 Calcolo
- 5.2 Esercizio 1
- 6 Molalità
- 6.1 Esercizio 1
- 7 Note e raccomandazioni importanti sulla concentrazione chimica
- 7.1 Il volume della soluzione è sempre maggiore di quello del solvente
- 7.2 Utilità della molarità
- 7.3 Le formule non vengono memorizzate ma le unità o le definizioni lo sono
- 8 Riferimenti
Soluzioni diluite e concentrate
Come puoi sapere se una concentrazione è molto diluita o concentrata? A prima vista dalla manifestazione di una qualsiasi delle sue proprietà organolettiche o chimiche; cioè quelli che i sensi percepiscono o che possono essere misurati.
L'immagine sopra mostra una diluizione di una concentrazione di bicromato di potassio (KDueCrDueO7), che presenta un colore arancione. Da sinistra a destra puoi vedere come il colore diminuisce la sua intensità man mano che la concentrazione viene diluita, aggiungendo altro solvente.
Questa diluizione permette di ottenere in questo modo una concentrazione diluita da una concentrata. Il colore (e altre proprietà "nascoste" nel suo nucleo arancione) cambia nello stesso modo della sua concentrazione, sia con le unità fisiche che chimiche..
Ma quali sono le unità chimiche di concentrazione? Tra questi ci sono la molarità o concentrazione molare di una soluzione, che mette in relazione le moli di soluto con il volume totale della soluzione in litri.
Esiste anche la molalità o anche chiamata concentrazione molale, che si riferisce alle moli di soluto ma che sono contenute in una quantità standardizzata di solvente o solvente che è esattamente un chilogrammo.
Questo solvente può essere puro o se la soluzione contiene più di un solvente, la molalità sarà le moli di soluto per chilogrammo della miscela di solventi..
E la terza unità di concentrazione chimica è la normalità o concentrazione normale di una soluzione che esprime il numero di equivalenti chimici del soluto per litro di soluzione.
L'unità in cui è espressa la normalità è in equivalenti per litro (Eq / L) e in medicina la concentrazione di elettroliti nel siero umano è espressa in milliequivalenti per litro (mEq / L).
Modi per esprimere la concentrazione

La concentrazione di una soluzione può essere denotata in tre modi principali, anche se hanno una grande varietà di termini e unità stessi, che possono essere utilizzati per esprimere la misura di questo valore: descrizione qualitativa, notazione quantitativa e classificazione in termini di solubilità.
A seconda della lingua e del contesto in cui si lavora, verrà scelto uno dei tre modi per esprimere la concentrazione di una miscela.
Descrizione qualitativa
Utilizzata principalmente in linguaggio informale e non tecnico, la descrizione qualitativa della concentrazione di una miscela è espressa sotto forma di aggettivi, che indicano in modo generalizzato il livello di concentrazione che una soluzione possiede.
In questo modo il livello minimo di concentrazione secondo la descrizione qualitativa è quello di una soluzione “diluita”, e il massimo è quello di “concentrato”..
Si parla di soluzioni diluite quando una soluzione ha una proporzione molto bassa di soluto in funzione del volume totale della soluzione. Se vuoi diluire una soluzione, devi aggiungere altro solvente o trovare un modo per ridurre il soluto.
Ora, parliamo di soluzioni concentrate quando hanno un'elevata proporzione di soluto in funzione del volume totale di soluzione. Per concentrare una soluzione è necessario aggiungere più soluto o ridurre la quantità di solvente.
In questo senso, questa classificazione è chiamata descrizione qualitativa, non solo perché manca di misurazioni matematiche ma anche per la sua qualità empirica (può essere attribuita a caratteristiche visive, odori e sapori, senza la necessità di test scientifici)..
Classificazione per solubilità
La solubilità di una concentrazione denota la capacità massima di soluto che una soluzione ha, a seconda di condizioni come temperatura, pressione e le sostanze che sono disciolte o in sospensione..
Le soluzioni possono essere classificate in tre tipi in base al loro livello di soluto disciolto al momento della misurazione: soluzioni insature, sature e sovrasature.
- Le soluzioni insature sono quelle che contengono meno soluto di quanto la soluzione possa dissolvere. In questo caso, la soluzione non ha raggiunto la sua concentrazione massima.
- Le soluzioni sature sono quelle in cui la massima quantità possibile di soluto si è dissolta nel solvente a una temperatura specifica. In questo caso c'è un equilibrio tra entrambe le sostanze e la soluzione non può accettare più soluto (poiché precipiterà).
- Le soluzioni sovrasature hanno più soluto di quanto la soluzione accetterebbe in condizioni di equilibrio. Ciò si ottiene riscaldando una soluzione satura, aggiungendo più soluto del normale. Una volta freddo, non farà precipitare il soluto automaticamente, ma qualsiasi disturbo può causare questo effetto a causa della sua instabilità..
Notazione quantitativa
Quando si studia una soluzione da utilizzare in campo tecnico o scientifico, è richiesta una precisione misurata ed espressa in unità, che descriva la concentrazione secondo i suoi esatti valori di massa e / o volume..
Questo è il motivo per cui esiste una serie di unità utilizzate per esprimere la concentrazione di una soluzione nella sua notazione quantitativa, che si dividono in fisiche e chimiche, e che a loro volta hanno le proprie suddivisioni.
Le unità di concentrazione fisica sono quelle di "concentrazione relativa", che sono espresse in termini di percentuali. Esistono tre modi per esprimere le concentrazioni percentuali: percentuali di massa, percentuali di volume e percentuali di volume di massa..
Invece, le unità di concentrazioni chimiche si basano su quantità molari, grammi equivalenti, parti per milione e altre caratteristiche del soluto rispetto alla soluzione..
Queste unità sono le più comuni a causa della loro elevata precisione durante la misurazione delle concentrazioni, e per questo motivo sono solitamente quelle che si desidera conoscere per lavorare con soluzioni chimiche..
Unità di concentrazione
Come descritto nelle sezioni precedenti, quando si caratterizza quantitativamente la concentrazione di una soluzione, i calcoli devono essere governati dalle unità esistenti a tal fine..
Allo stesso modo, le unità di concentrazione sono divise in quelle di concentrazione relativa, quelle di concentrazioni diluite, quelle basate su moli e altre aggiuntive..
Unità di concentrazione relativa
Le concentrazioni relative sono quelle espresse in percentuale, come indicato nella sezione precedente. Queste unità sono suddivise in percentuale massa-massa, percentuale volume-volume e percentuale massa-volume e vengono calcolate come segue:
- % massa = massa del soluto (g) / massa della soluzione totale (g) x 100
- % volume = volume del soluto (ml) / volume della soluzione totale (ml) x 100
- % massa / volume = massa del soluto (g) / volume della soluzione totale (ml) x 100
In questo caso, per calcolare la massa o il volume della soluzione totale, è necessario aggiungere la massa o il volume del soluto a quello del solvente..
Unità di concentrazione diluita
Le unità di concentrazione diluita sono quelle usate per esprimere quelle concentrazioni molto piccole che si trovano sotto forma di tracce all'interno di una soluzione diluita; l'uso più comune di queste unità è quello di trovare tracce di un gas disciolto in un altro, come agenti che inquinano l'aria.
Queste unità sono indicate sotto forma di parti per milione (ppm), parti per miliardo (ppb) e parti per trilione (ppt) e sono espresse come segue:
- ppm = 1 mg di soluto / 1 L di soluzione
- ppb = 1 μg di soluto / 1 L di soluzione
- ppt = 1 ng soluto / 1 L soluzione
In queste espressioni, mg è uguale a milligrammi (0,001 g), μg è uguale a microgrammi (0,000001 g) e ng è uguale a nanogrammi (0,000000001 g). Queste unità possono anche essere espresse in funzione del volume / volume.
Unità di concentrazione in funzione delle moli
Le unità di concentrazione basate sulle moli sono quelle della frazione molare, della percentuale molare, della molarità e della molalità (queste ultime due sono meglio descritte alla fine dell'articolo).
La frazione molare di una sostanza è la frazione di tutte le sue molecole costituenti (o atomi) in funzione delle molecole o degli atomi totali. Viene calcolato come segue:
XPER = numero di moli di sostanza A / numero totale di moli in soluzione
Questa procedura viene ripetuta per le altre sostanze in soluzione, tenendo conto che la somma di XPER + XB + XC ... deve essere uguale a uno.
La percentuale in mole viene lavorata in modo simile a XPER, solo in percentuale:
Percentuale molare di A = XPER x 100%
La sezione finale discuterà in dettaglio la molarità e la molalità..
Formalità e normalità
Infine, ci sono due unità di concentrazione attualmente in disuso: la formalità e la normalità..
La formalità di una soluzione rappresenta il numero di peso-formula-grammo per litro di soluzione totale. È espresso come:
F = No. P.F.G / L soluzione
In questa espressione P.F.G è uguale al peso di ogni atomo della sostanza, espresso in grammi.
Invece, la normalità rappresenta il numero di equivalenti di soluto diviso per litri di soluzione, come espresso di seguito:
N = grammi equivalenti di soluto / L soluzione
In questa espressione, i grammi equivalenti di soluto possono essere calcolati dal numero di moli H+, Oh- o altri metodi, a seconda del tipo di molecola.
Molarità
La molarità o concentrazione molare di un soluto è l'unità di concentrazione chimica che esprime o mette in relazione le moli del soluto (n) contenute in un (1) litro (L) della soluzione.
La molalità è indicata dalla lettera maiuscola M e per determinare le moli del soluto (n), i grammi del soluto (g) sono divisi per il peso molecolare (MW) del soluto..
Allo stesso modo, il peso molecolare MW del soluto è ottenuto dalla somma dei pesi atomici (PA) o massa atomica degli elementi chimici, considerando la proporzione in cui si combinano per formare il soluto. Pertanto, diversi soluti hanno il proprio PM (anche se questo non è sempre il caso).
Queste definizioni sono riassunte nelle seguenti formule utilizzate per eseguire i calcoli corrispondenti:
Molarità: M = n (moli di soluto) / V (litro di soluzione)
Numero di moli: n = g di soluto / MW di soluto
Esercizio 1
Calcola la Molarità di una soluzione preparata con 45 g di Ca (OH)Due sciolto in 250 mL di acqua.
La prima cosa da calcolare è il peso molecolare di Ca (OH)Due (idrossido di calcio). Secondo la sua formula chimica, il composto è costituito da un catione di calcio e due anioni idrossilici. Qui il peso di un elettrone inferiore o aggiuntivo alla specie è trascurabile, quindi si prendono i pesi atomici:
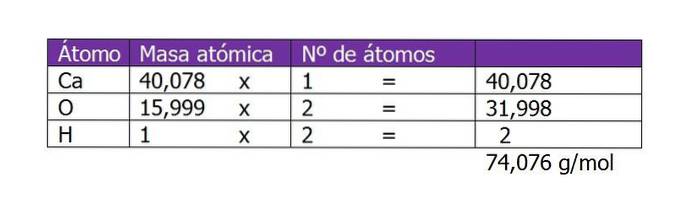
Il numero di moli del soluto sarà quindi:
n = 45 g / (74 g / mol)
n = 0,61 moli di Ca (OH)Due
Si ottengono 0,61 moli del soluto ma è importante ricordare che queste moli giacciono disciolte in 250 mL di soluzione. Poiché la definizione di molarità è talpe in a litro o 1000 mL, si deve quindi fare una semplice regola di tre per calcolare le moli che sono in 1000 mL di detta soluzione
Se in 250 mL di soluzione ci sono => 0,61 moli di soluto
In 1000 mL di soluzione => x Quante moli ci sono?
x = (0,61 mol) (1000 mL) / 250 mL
X = 2,44 M (mol / L)
Un altro modo
L'altro modo per ottenere le talpe per applicare la formula prevede che i 250 mL siano portati a litri, applicando anche una regola del tre:
Se 1000 ml => sono 1 litro
250 ml => x quanti litri sono?
x = (250 mL) (1 L) / 1000 mL
x = 0,25 L
Sostituendo quindi nella formula Molarità:
M = (0,61 moli di soluto) / (0,25 L di soluzione)
M = 2,44 mol / L
Esercizio 2
Cosa significa per una soluzione di HCl essere 2,5 M.?
La soluzione di HCl è 2,5 molare, cioè un litro ha sciolto 2,5 moli di acido cloridrico..
Normale
La normalità o concentrazione equivalente, è l'unità di concentrazione chimica delle soluzioni che viene indicata con la lettera maiuscola N. Questa unità di concentrazione indica la reattività del soluto ed è uguale al numero di equivalenti di soluto (Eq) tra il volume della soluzione espresso in litri.
N = Eq / L
Il numero di equivalenti (Eq) è uguale ai grammi di soluto diviso per il peso equivalente (PEq).
Eq = g soluto / PEq
Il peso equivalente, o anche detto grammo equivalente, si calcola ottenendo il peso molecolare del soluto e dividendolo per un fattore equivalente che ai fini di riassumere nell'equazione si chiama delta zeta (ΔZ).
PEq = PM / ΔZ
Calcolo
Il calcolo della normalità avrà una variazione molto specifica del fattore equivalente o ΔZ, che dipende anche dal tipo di reazione chimica a cui partecipa la specie soluto o reattiva. Alcuni casi di questa variazione possono essere menzionati di seguito:
-Quando si tratta di un acido o di una base, ΔZ o il fattore equivalente, sarà uguale al numero di ioni idrogeno (H+) o idrossile OH- che ha il soluto. Ad esempio, l'acido solforico (H.DueSW4) ha due equivalenti perché ha due protoni acidi.
-Quando si tratta di reazioni di riduzione dell'ossidazione, ΔZ corrisponderà al numero di elettroni coinvolti nel processo di ossidazione o riduzione, a seconda del caso specifico. È qui che entra in gioco il bilanciamento delle equazioni chimiche e la specificazione della reazione..
-Allo stesso modo, questo fattore equivalente o ΔZ corrisponderà al numero di ioni che precipitano nelle reazioni classificate come precipitazione..
Esercizio 1
Determina la normalità di 185 g di NaDueSW4 trovato in 1,3 L di soluzione.
Il peso molecolare del soluto in questa soluzione verrà calcolato per primo:
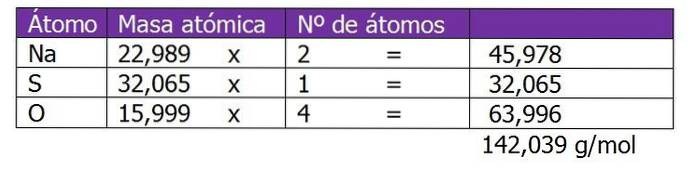
Il secondo passaggio consiste nel calcolare il fattore equivalente o ΔZ. In questo caso, poiché il solfato di sodio è un sale, verrà considerata la valenza o carica del catione o del metallo Na.+, che sarà moltiplicato per 2, che è il pedice della formula chimica del sale o del soluto:
N / ADueSW4 => ∆Z = Valencia Catione x Pedice
∆Z = 1 x 2
Per ottenere il peso equivalente, viene sostituito nella rispettiva equazione:
PEq = (142,039 g / mol) / (2 Eq / mol)
PEq = 71,02 g / Eq
E quindi puoi procedere al calcolo del numero di equivalenti, ricorrendo nuovamente a un altro semplice calcolo:
Eq = (185 g) / (71,02 g / Eq)
Numero di equivalenti = 2.605 Eq
Infine, con tutti i dati necessari, la normalità viene ora calcolata sostituendo secondo la sua definizione:
N = 2.605 Eq / 1.3 L
N = 2,0 N
Molalità
La molalità è indicata dalla lettera minuscola m y è uguale alle moli di soluto presenti in un (1) chilogrammo di solvente. È anche noto come concentrazione molale e viene calcolato utilizzando la seguente formula:
m = moli di soluto / Kg di solvente
Mentre la molalità stabilisce il rapporto tra le moli di soluto contenute in un (1) litro di soluzione, la molalità si riferisce alle moli di soluto che esistono in un (1) chilogrammo di solvente.
In quei casi in cui la soluzione è preparata con più di un solvente, la molalità esprimerà le stesse moli di soluto per chilogrammo della miscela di solventi..
Esercizio 1
Determinare la molalità di una soluzione preparata mescolando 150 g di saccarosio (C.12H220undici) con 300 g di acqua.
Il peso molecolare del saccarosio viene prima determinato per procedere al calcolo delle moli di soluto in questa soluzione:
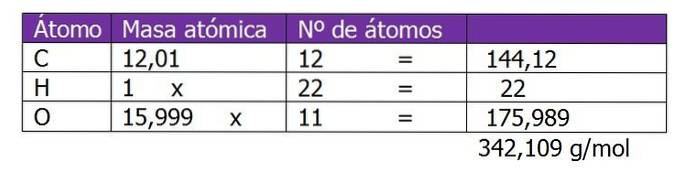
Il numero di moli di saccarosio viene calcolato:
n = (150 g di saccarosio) / (342,109 g / mol)
n = 0,438 moli di saccarosio
Quindi i grammi di solvente vengono portati a chilogrammi per poter applicare la formula finale.
Sostituendo quindi:
m = 0,438 moli di saccarosio / 0,3 chilogrammi di acqua
m = 1,46 mol C12H220undici/ Kg HDueO
Sebbene attualmente sia in corso un dibattito sull'espressione finale della molalità, questo risultato può anche essere espresso come:
1,26 m C12H220undici o 1,26 molali
Talvolta si ritiene vantaggioso esprimere la concentrazione della soluzione in termini di molalità, poiché le masse del soluto e del solvente non subiscono leggere fluttuazioni o variazioni inapparenti dovute agli effetti della temperatura o della pressione; come accade nelle soluzioni con soluto gassoso.
Inoltre, si evidenzia che questa unità di concentrazione riferita ad uno specifico soluto è invariata dall'esistenza di altri soluti nella soluzione..
Raccomandazioni e note importanti sulla concentrazione chimica
Il volume della soluzione è sempre maggiore di quello del solvente
Quando gli esercizi risolutivi vengono risolti, sorge l'errore di interpretare il volume di una soluzione come se fosse quello del solvente. Ad esempio, se un grammo di cioccolato in polvere viene sciolto in un litro d'acqua, il volume della soluzione non è uguale a quello di un litro d'acqua..
Perchè no? Perché il soluto occuperà sempre lo spazio tra le molecole di solvente. Quando il solvente ha un'elevata affinità per il soluto, la variazione di volume dopo la dissoluzione può essere trascurabile o trascurabile..
Ma, in caso contrario, e ancor di più se la quantità di soluto è grande, è necessario tenere conto della variazione di volume. In questo modo: Vsolvent + Vsolute = Vsolution. Solo in soluzioni diluite o dove le quantità di soluto sono piccole è valido Vsolvent = Vsolution.
Questo errore deve essere tenuto presente soprattutto quando si lavora con soluti liquidi. Ad esempio, se invece di sciogliere il cioccolato in polvere, il miele viene sciolto in alcool, il volume del miele aggiunto avrà effetti significativi sul volume totale della soluzione..
Pertanto, in questi casi il volume del soluto deve essere aggiunto a quello del solvente..
Utilità della molalità
-Conoscere la Molarità di una soluzione concentrata consente di effettuare calcoli di diluizione utilizzando la formula semplice M1V1 = M2V2, dove M1 corrisponde alla Molarità iniziale della soluzione e M2 la Molarità della soluzione da preparare dalla soluzione M1.
-Conoscendo la Molarità di una soluzione, la sua Normalità può essere facilmente calcolata utilizzando la seguente formula: Normalità = numero di equivalenti x M
Le formule non vengono memorizzate ma le unità o le definizioni lo sono
Tuttavia, a volte la memoria non riesce a ricordare tutte le equazioni pertinenti ai calcoli della concentrazione. Per questo, è molto utile avere una definizione molto chiara di ogni concetto.
Dalla definizione, le unità vengono scritte utilizzando il fattori di conversione per esprimere quelli che corrispondono a ciò che vuoi determinare.
Ad esempio, se hai la molalità e vuoi convertirla in normale, procedi come segue:
(mol / Kg solvente) x (kg / 1000g) (g solvente / mL) (mL solvente / mL soluzione) (1000mL / L) (Eq / mol)
Notare che (g solvente / mL) è la densità del solvente. Il termine (mL di solvente / mL di soluzione) si riferisce a quanto volume della soluzione corrisponde effettivamente al solvente. In molti esercizi quest'ultimo termine è uguale a 1, per ragioni pratiche, anche se non è mai del tutto vero..
Riferimenti
- Chimica introduttiva - 1st Edizione canadese. Unità quantitative di concentrazione. Capitolo 11 Soluzioni. Tratto da: opentextbc.ca
- Wikipedia. (2018). Concentrazione equivalente. Tratto da: en.wikipedia.org
- PharmaFactz. (2018). Cos'è la molarità? Tratto da: pharmafactz.com
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). CENGAGE Learning, p. 101-103, 512, 513.
- Soluzioni acquose-molarità. Tratto da: chem.ucla.edu
- Quimicas.net (2018). Esempi di normalità. Estratto da: quimicas.net.



Nessun utente ha ancora commentato questo articolo.