
Proprietà, struttura e usi dell'acido solforico (H2SO4)
Il acido solforico (H.DueSW4) È un composto chimico liquido, oleoso e incolore, solubile in acqua con rilascio di calore e corrosivo per metalli e tessuti. Carbonizza il legno e la maggior parte della materia organica a contatto con esso, ma è improbabile che provochi un incendio.
L'acido solforico è forse il più importante di tutti i prodotti chimici industriali pesanti e il suo consumo è stato più volte citato come indicatore dello stato generale dell'economia di una nazione..

L'esposizione a lungo termine a basse concentrazioni o l'esposizione a breve termine a concentrazioni elevate può provocare effetti nocivi sulla salute. L'uso di gran lunga più importante dell'acido solforico è nell'industria dei fertilizzanti fosfatici.
Altre importanti applicazioni sono la raffinazione del petrolio, la produzione di pigmenti, il decapaggio dell'acciaio, l'estrazione di metalli non ferrosi e la produzione di esplosivi, detergenti, plastica, fibre sintetiche e prodotti farmaceutici..
Indice articolo
- 1 Vetriolo, l'antecedente dell'acido solforico
- 2 Formula
- 3 Struttura chimica
- 3.1 In 2D
- 3.2 In 3D
- 4 caratteristiche
- 4.1 Proprietà fisiche e chimiche
- 4.2 Reazioni con aria e acqua
- 4.3 Infiammabilità
- 4.4 Reattività
- 4.5 Tossicità
- 5 Usi
- 5.1 Indiretto
- 5.2 Diretto
- 6 Lo sviluppo dell'industria dell'acido solforico
- 6.1 Processo al vetriolo
- 6.2 Camere di piombo
- 7 Produzione attuale: processo di contatto
- 7.1 Processo di doppio contatto
- 8 Materie prime utilizzate nella produzione di acido solforico
- 8.1 Pirite
- 8.2 Anidride solforosa
- 8.3 Riciclato
- 9 Effetti clinici
- 10 Sicurezza e rischi
- 10.1 Classi di pericolo GHS
- 10.2 Codici dei consigli di prudenza
- 11 Riferimenti
Vetriolo, l'antecedente dell'acido solforico
Nell'Europa medievale l'acido solforico era conosciuto dagli alchimisti come vetriolo, olio al vetriolo o liquore al vetriolo. Era considerata la sostanza chimica più importante e si è cercato di essere utilizzata come pietra filosofale.
I Sumeri avevano già un elenco di vari tipi di vetriolo. Inoltre, Galeno, il medico greco Dioscoride e Plinio il Vecchio ne aumentarono l'uso medico.

Nelle opere alchemiche ellenistiche si parlava già degli usi metallurgici delle sostanze al vetriolo. Il vetriolo è un gruppo di minerali vetrosi da cui si può ottenere acido solforico.
Formula
-Formula: HDueSW4
-Numero CAS: 7664-93-9
Struttura chimica
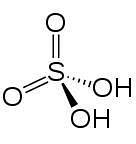
In 2D
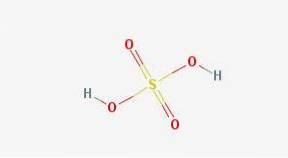
In 3d
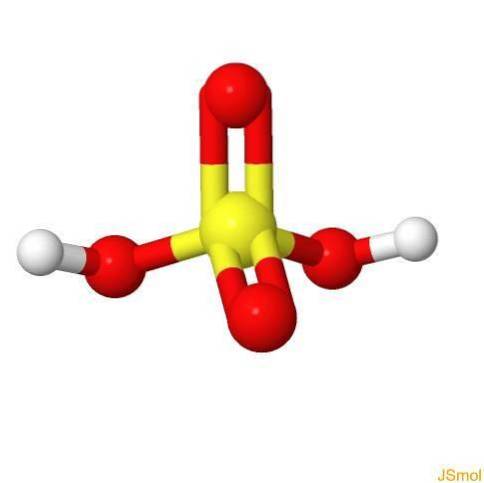
Caratteristiche
Proprietà fisiche e chimiche

L'acido solforico appartiene al gruppo reattivo dei forti acidi ossidanti.
Reazioni con aria e acqua
- La reazione con l'acqua è trascurabile a meno che l'acidità non sia superiore all'80-90%, quindi il calore di idrolisi è estremo, può causare gravi ustioni.
Infiammabilità
- Gli acidi ossidanti forti sono generalmente non infiammabili. Possono accelerare la combustione di altri materiali fornendo ossigeno al sito di combustione.
- Tuttavia, l'acido solforico è altamente reattivo e in grado di accendere materiali combustibili finemente suddivisi quando viene a contatto con essi..
- Quando riscaldato, emette fumi altamente tossici.
- È esplosivo o incompatibile con un'enorme varietà di sostanze.
- Può subire violenti mutamenti chimici ad alte temperature e pressioni.
- Può reagire violentemente con l'acqua.
Reattività
- L'acido solforico è fortemente acido.
- Reagisce violentemente con il pentafluoruro di bromo.
- Esplodere con para-nitrotoluene a 80 ° C.
- Un'esplosione si verifica quando l'acido solforico concentrato viene miscelato con permanganato di potassio cristallino in un contenitore che contiene umidità. Si forma eptoossido di manganese, che esplode a 70 ° C.
- La miscela di acrilonitrile con acido solforico concentrato deve essere mantenuta ben refrigerata, altrimenti si verifica una vigorosa reazione esotermica.
- La temperatura e la pressione aumentano quando l'acido solforico (96%) viene miscelato in parti uguali in un contenitore chiuso con una delle seguenti sostanze: acetonitrile, acroleina, 2-amminoetanolo, idrossido di ammonio (28%), anilina, n-butirraldeide, clorosolfonico acido, etilendiammina, etilenimmina, epicloridrina, etilene cianoidrina, acido cloridrico (36%), acido fluoridrico (48,7%), ossido di propilene, idrossido di sodio, stirene monomero.
- L'acido solforico (concentrato) è estremamente pericoloso a contatto con carburi, bromati, clorati, primer, picrati e metalli in polvere..
- Può indurre una violenta polimerizzazione del cloruro di allile e reagisce esotermicamente con l'ipoclorito di sodio per produrre cloro gassoso.
- Mescolando acido clorosolforico e acido solforico al 98% si ottiene HCl.
Tossicità
- L'acido solforico è corrosivo per tutti i tessuti del corpo. L'inalazione di vapore può causare gravi danni ai polmoni. Il contatto con gli occhi può provocare la perdita totale della vista. Il contatto con la pelle può causare necrosi grave.
- L'ingestione di acido solforico, in una quantità compresa tra 1 cucchiaino e mezza oncia della sostanza chimica concentrata, può essere fatale per un adulto. Anche poche gocce possono essere fatali se l'acido penetra nella trachea.
- L'esposizione cronica può causare tracheobronchite, stomatite, congiuntivite e gastrite. Possono verificarsi perforazione gastrica e peritonite, seguite da collasso circolatorio. Lo shock circolatorio è spesso la causa immediata della morte.
- Quelli con malattie respiratorie croniche, gastrointestinali o nervose e qualsiasi malattia degli occhi e della pelle sono a maggior rischio.
Applicazioni
- L'acido solforico è uno dei prodotti chimici industriali più utilizzati al mondo. Ma la maggior parte dei suoi usi può essere considerata indiretta, partecipando come reagente piuttosto che come ingrediente.
- La maggior parte dell'acido solforico finisce come acido speso nella produzione di altri composti o come qualche tipo di residuo di solfato.
- Alcuni prodotti incorporano zolfo o acido solforico, ma quasi tutti sono prodotti speciali a basso volume..
- Circa il 19% dell'acido solforico prodotto nel 2014 è stato consumato in una ventina di processi chimici e il resto è stato consumato in un'ampia varietà di applicazioni industriali e tecniche.
- La crescita della domanda di acido solforico a livello mondiale è dovuta, in ordine decrescente, alla produzione di: acido fosforico, biossido di titanio, acido fluoridrico, solfato di ammonio e nella lavorazione dell'uranio e nelle applicazioni metallurgiche.
Indiretto
- Il maggior consumatore di acido solforico è di gran lunga l'industria dei fertilizzanti. Rappresentava poco più del 58% del consumo mondiale totale nel 2014. Tuttavia, questa percentuale dovrebbe scendere a circa il 56% entro il 2019, principalmente a causa della maggiore crescita in altre applicazioni chimiche e industriali..
- La produzione di materiali fertilizzanti fosfatici, in particolare acido fosforico, è il mercato principale per l'acido solforico. Viene anche utilizzato per la produzione di materiali fertilizzanti come il triplo perfosfato e i fosfati mono e diammonici. Quantità minori vengono utilizzate per la produzione di perfosfato e solfato di ammonio.
- In altre applicazioni industriali, quantità sostanziali di acido solforico vengono utilizzate come mezzo di reazione di disidratazione acida, nella chimica organica e nei processi petrolchimici che coinvolgono reazioni come nitrazione, condensazione e disidratazione, nonché nella raffinazione del petrolio., Dove viene utilizzato nella raffinazione, alchilazione e purificazione di distillati grezzi.
- Nell'industria chimica inorganica, il suo utilizzo è notevole nella produzione di pigmenti TiO2, acido cloridrico e acido fluoridrico..
- Nell'industria della lavorazione dei metalli, l'acido solforico viene utilizzato per il decapaggio dell'acciaio, la lisciviazione dei minerali di rame, uranio e vanadio nella lavorazione idrometallurgica dei minerali e nella preparazione di bagni elettrolitici per la purificazione e la placcatura dei metalli. ferroso.
- Alcuni processi di fabbricazione della pasta di legno nell'industria della carta, nella produzione di alcuni tessuti, nella fabbricazione di fibre chimiche e nella concia delle pelli richiedono anche acido solforico.
Diretto
- Probabilmente il più grande utilizzo di acido solforico, in cui lo zolfo è incorporato nel prodotto finale, è nel processo di solfonazione organica, in particolare per la produzione di detergenti..
- La solfonazione svolge anche un ruolo importante nell'ottenere altri prodotti chimici organici e prodotti farmaceutici minori..
- Le batterie al piombo sono uno dei più noti prodotti di consumo contenenti acido solforico, rappresentando solo una piccola frazione del consumo totale di acido solforico..
- In determinate condizioni, l'acido solforico viene utilizzato direttamente in agricoltura per la riabilitazione di suoli altamente alcalini, come quelli che si trovano nelle regioni desertiche degli Stati Uniti occidentali. Tuttavia, questo uso non è molto importante in termini di volume totale di acido solforico utilizzato..
Lo sviluppo dell'industria dell'acido solforico
Processo al vetriolo

Il metodo più antico per ottenere l'acido solforico è il cosiddetto “processo al vetriolo”, che si basa sulla decomposizione termica dei vetrioli, che sono solfati di vario tipo, di origine naturale..
Gli alchimisti persiani Jābir ibn Hayyān (noto anche come Geber, 721-815 d.C.), Razi (865-925 d.C.) e Jamal Din al-Watwat (1318 d.C.), includevano il vetriolo nelle loro liste di classificazione dei minerali.
La prima menzione del "processo al vetriolo" appare negli scritti di Jabir ibn Hayyan. Quindi gli alchimisti Sant'Alberto Magno e Basilio Valentino descrissero il processo in modo più dettagliato. Come materie prime sono stati utilizzati allume e calcantite (vetriolo blu).
Alla fine del Medioevo, l'acido solforico veniva ottenuto in piccole quantità in contenitori di vetro, nei quali lo zolfo veniva bruciato con salnitro in ambiente umido..
Il processo al vetriolo è stato utilizzato su scala industriale dal XVI secolo a causa di una maggiore richiesta di acido solforico.
Vetriolo di Nordhausen
Il fulcro della produzione era nella città tedesca di Nordhausen (motivo per cui il vetriolo cominciò a essere chiamato "vetriolo di Nordhausen"), dove il solfato di ferro (II) (vetriolo verde, FeSO4 - 7HDueO) come materia prima, che è stata riscaldata, e il triossido di zolfo risultante è stato miscelato con acqua per ottenere acido solforico (olio di vetriolo).
Il processo è stato eseguito in galere, alcune delle quali a più livelli, in parallelo, al fine di ottenere maggiori quantità di olio al vetriolo..
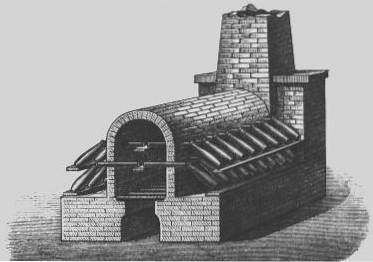
Camere di piombo
Nel XVIII secolo, fu sviluppato un processo più economico per la produzione di acido solforico noto come "processo della camera di piombo".
Fino ad allora la concentrazione massima di acido ottenuta era del 78%, mentre con il "processo al vetriolo" si otteneva acido ed oleum concentrati, quindi questo metodo continuò ad essere utilizzato in alcuni settori dell'industria fino alla comparsa del "processo di contatto" nel 1870, con il quale si poteva ottenere un acido concentrato più economico.
L'oleio o acido solforico fumante (CAS: 8014-95-7), è una soluzione di consistenza oleosa e di colore marrone scuro, con una composizione variabile di anidride solforica e acido solforico, che può essere descritta dalla formula HDueSW4.xSO3 (dove x rappresenta il contenuto molare libero di ossido di zolfo (VI)). Un valore per x di 1 dà la formula empirica HDueSDueO7, corrispondente all'acido disolforico (o acido pirosolforico).
Processi
Il processo della camera di piombo era il metodo industriale utilizzato per produrre acido solforico in grandi quantità, prima di essere soppiantato dal "processo di contatto".
Nel 1746 a Birmingham, in Inghilterra, John Roebuck iniziò a produrre acido solforico in camere rivestite di piombo, che erano più resistenti e meno costose dei contenitori di vetro precedentemente utilizzati e potevano essere rese molto più grandi.
L'anidride solforosa (dalla combustione di zolfo elementare o minerali metallici contenenti zolfo, come la pirite) è stata introdotta con vapore e ossido di azoto in grandi camere rivestite con fogli di piombo..
L'anidride solforosa e il biossido di azoto si sono sciolti e, per un periodo di circa 30 minuti, l'anidride solforosa è stata ossidata ad acido solforico..
Ciò ha consentito l'efficace industrializzazione della produzione di acido solforico e, con vari affinamenti, questo processo è rimasto il metodo di produzione standard per quasi due secoli..
Nel 1793, Clemente e Desormes ottennero risultati migliori introducendo aria supplementare nel processo della camera di piombo..
Nel 1827 Gay-Lussac introdusse un metodo per assorbire gli ossidi di azoto dai gas di scarico della camera di piombo..
Nel 1859 Glover sviluppò un metodo per il recupero degli ossidi di azoto dall'acido neoformato, mediante strippaggio con gas caldi, che consentiva di effettuare in continuo il processo di catalizzazione dell'ossido di azoto..
Nel 1923, Petersen introdusse un processo torre migliorato che gli consentì di essere competitivo con il processo di contatto fino agli anni '50..
Il processo della camera divenne così robusto che nel 1946 rappresentava ancora il 25% della produzione mondiale di acido solforico..
Produzione attuale: processo di contatto
Il processo di contatto è l'attuale metodo per produrre acido solforico in alte concentrazioni, necessario nei moderni processi industriali. Il platino era il catalizzatore di questa reazione. Tuttavia, ora è preferito il pentossido di vanadio (V2O5).
Nel 1831, a Bristol, in Inghilterra, Peregrine Phillips brevettò l'ossidazione dell'anidride solforosa in triossido di zolfo utilizzando un catalizzatore di platino a temperature elevate..
Tuttavia, l'adozione della sua invenzione e lo sviluppo intensivo del processo di contatto iniziarono solo dopo che la domanda di oleum per la produzione di colorante aumentò dal 1872 circa in poi..
Successivamente, sono stati cercati catalizzatori solidi migliori e sono state studiate la chimica e la termodinamica dell'equilibrio SO2 / SO3..
Il processo di contatto può essere suddiviso in cinque fasi:
- Combinazione di zolfo e diossigeno (O2) per formare anidride solforosa.
- Purificazione dell'anidride solforosa in un'unità di depurazione.
- Aggiunta di ossigeno in eccesso ad anidride solforosa in presenza di catalizzatore a pentossido di vanadio, a temperature di 450 ° C e pressione di 1-2 atm.
- Il triossido di zolfo formatosi viene aggiunto all'acido solforico dando origine all'oleum (acido disolforico).
- L'oleio viene quindi aggiunto all'acqua per formare acido solforico che è altamente concentrato..
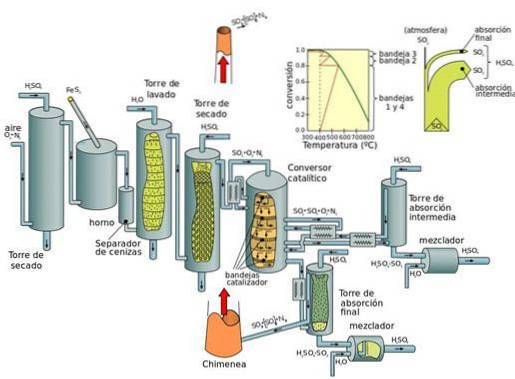
Lo svantaggio fondamentale dei processi con ossido di azoto (durante il processo della camera di piombo) è che la concentrazione di acido solforico ottenuta è limitata a un massimo dal 70 al 75%, mentre il processo di contatto produce acido concentrato (98%).
Con lo sviluppo di catalizzatori di vanadio relativamente economici per il processo di contatto, insieme alla crescente domanda di acido solforico concentrato, la produzione globale di acido solforico negli impianti di trattamento dell'ossido di azoto è diminuita costantemente..
Nel 1980 praticamente non veniva prodotto acido negli impianti di trattamento degli ossidi di azoto in Europa occidentale e Nord America.
Processo a doppio contatto
Il processo di doppio assorbimento a doppio contatto (DCDA o Double Contact Double Absorption) ha introdotto miglioramenti al processo di contatto per la produzione di acido solforico.
Nel 1960, Bayer ha richiesto un brevetto per il cosiddetto processo di doppia catalisi. Il primo impianto ad utilizzare questo processo è stato avviato nel 1964.
Incorporando uno stadio di assorbimento di SO3 Prima delle fasi catalitiche finali, il processo di contatto migliorato ha consentito un aumento significativo della conversione di SO.Due , riducendo sostanzialmente le sue emissioni in atmosfera.
I gas vengono ritrasferiti attraverso la colonna di assorbimento finale, ottenendo non solo un'elevata performance di conversione dell'SODue a SO3 (di circa il 99,8%), ma consentendo anche la produzione di una maggiore concentrazione di acido solforico.
La differenza essenziale tra questo processo e il normale processo di contatto è nel numero di fasi di assorbimento..
A partire dagli anni '70, i principali paesi industriali hanno introdotto normative più severe per la tutela dell'ambiente e il processo di doppia acquisizione si è diffuso nei nuovi stabilimenti. Tuttavia, il processo di contatto convenzionale è ancora utilizzato in molti paesi in via di sviluppo con standard ambientali meno rigorosi..
L'impulso maggiore per l'attuale sviluppo del processo di contatto è focalizzato sull'aumento del recupero e dell'utilizzo della grande quantità di energia prodotta nel processo..
In effetti, un grande e moderno impianto di acido solforico può essere visto non solo come un impianto chimico, ma anche come una centrale termica..
Materie prime utilizzate nella produzione di acido solforico
Pirite
La pirite è stata la materia prima dominante nella produzione di acido solforico fino alla metà del XX secolo, quando si è iniziato a recuperare grandi quantità di zolfo elementare dal processo di raffinazione del petrolio e dalla purificazione del gas naturale, diventando il principale premio dell'industria dei materiali.
Diossido di zolfo
Attualmente, l'anidride solforosa viene ottenuta con metodi diversi, da varie materie prime.
Negli Stati Uniti, l'industria si è basata sin dai primi anni del XX secolo sull'ottenimento di zolfo elementare da depositi sotterranei mediante il "Processo Frasch".
L'acido solforico moderatamente concentrato viene anche prodotto per riconcentrazione e purificazione di grandi quantità di acido solforico ottenuto come sottoprodotto di altri processi industriali..
Raccolta differenziata
Il riciclo di questo acido è sempre più importante dal punto di vista ambientale, soprattutto nei principali paesi sviluppati..
La produzione di acido solforico a base di zolfo elementare e pirite è, ovviamente, relativamente sensibile alle condizioni di mercato, poiché l'acido prodotto da questi materiali rappresenta un prodotto primario..
Al contrario, quando l'acido solforico è un sottoprodotto, fabbricato come mezzo per rimuovere i rifiuti da un altro processo, il livello della sua produzione non è dettato dalle condizioni del mercato dell'acido solforico, ma dalle condizioni di mercato del prodotto primario.
Effetti clinici
-L'acido solforico è utilizzato nell'industria e in alcuni prodotti per la pulizia della casa, come i detergenti per il bagno. Utilizzato anche nelle batterie.
-L'ingestione intenzionale, in particolare di prodotti altamente concentrati, può causare lesioni gravi e morte. Queste esposizioni all'ingestione sono rare negli Stati Uniti, ma sono prevalenti in altre parti del mondo..
-È un acido forte che provoca danni ai tessuti e la coagulazione delle proteine. È corrosivo per la pelle, gli occhi, il naso, le mucose, le vie respiratorie e il tratto gastrointestinale o qualsiasi tessuto con cui viene a contatto..
-La gravità della lesione è determinata dalla concentrazione e dalla durata del contatto.
-Esposizioni più lievi (concentrazioni inferiori al 10%) causano solo irritazione della pelle, del tratto respiratorio superiore e della mucosa gastrointestinale.
-Gli effetti respiratori dell'esposizione acuta per inalazione includono: irritazione del naso e della gola, tosse, starnuti, broncospasmo riflesso, dispnea ed edema polmonare. La morte può verificarsi a causa di un improvviso collasso circolatorio, edema della glottide e coinvolgimento delle vie aeree o lesioni polmonari acute.
-L'ingestione di acido solforico può causare dolore epigastrico immediato, nausea, salivazione e vomito di materiale mucoide o emorragico che assomiglia a "fondi di caffè". Di tanto in tanto si osserva vomito di sangue fresco.
-L'ingestione di acido solforico concentrato può portare alla corrosione dell'esofago, necrosi e perforazione dell'esofago o dello stomaco, specialmente nel piloro. Occasionalmente, si osservano lesioni all'intestino tenue. Le complicazioni successive possono includere stenosi e formazione di fistole. Dopo l'ingestione, può svilupparsi acidosi metabolica.
-Gravi ustioni della pelle possono verificarsi con necrosi e cicatrici. Questi possono essere fatali se viene interessata un'area sufficientemente ampia della superficie corporea..
-L'occhio è particolarmente sensibile alle lesioni da corrosione. Irritazione, lacrimazione e congiuntivite possono svilupparsi anche con basse concentrazioni di acido solforico. Schizzi di acido solforico in alte concentrazioni causano: ustioni corneali, perdita della vista e occasionalmente perforazione del globo.
-L'esposizione cronica può essere associata a cambiamenti nella funzione polmonare, bronchite cronica, congiuntivite, enfisema, infezioni respiratorie frequenti, gastrite, erosione dello smalto dei denti e possibilmente cancro delle vie respiratorie..
Sicurezza e rischi
Indicazioni di pericolo del Sistema mondiale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS)
Il sistema globale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS) è un sistema concordato a livello internazionale, creato dalle Nazioni Unite progettato per sostituire i vari standard di classificazione ed etichettatura utilizzati in diversi paesi utilizzando criteri coerenti a livello globale (Nations United, 2015 ).
Le classi di pericolo (e il corrispondente capitolo GHS), gli standard di classificazione ed etichettatura e le raccomandazioni per l'acido solforico sono i seguenti (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):
Classi di pericolo GHS
H303: Può essere nocivo se ingerito [Attenzione Tossicità acuta, per via orale - Categoria 5] (PubChem, 2017).
H314: Provoca gravi ustioni cutanee e gravi lesioni oculari [Pericolo Corrosione / irritazione cutanea - Categoria 1A, B, C] (PubChem, 2017).
H318: Provoca gravi lesioni oculari [Pericolo Lesioni oculari gravi / irritazione oculare - Categoria 1] (PubChem, 2017).
H330: Letale per inalazione [Pericolo di tossicità acuta, inalazione - Categoria 1, 2] (PubChem, 2017).
H370: Provoca danni agli organi [Tossicità specifica per organi bersaglio, esposizione singola - Categoria 1] (PubChem, 2017).
H372: Provoca danni agli organi in caso di esposizione prolungata o ripetuta [Pericolo Tossicità specifica per organi bersaglio, esposizione ripetuta - Categoria 1] (PubChem, 2017).
H402: Nocivo per la vita acquatica [Pericoloso per l'ambiente acquatico, pericolo acuto - Categoria 3] (PubChem, 2017).
Codici dei consigli di prudenza
P260, P264, P270, P271, P273, P280, P284, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P307 + P311, P310, P312, P314, P320, P321, P363, P403 + P233, P405 e P501 (PubChem, 2017).
Riferimenti
- Arribas, H. (2012) Diagramma della produzione di acido solforico con il metodo di contatto utilizzando pirite come materia prima [immagine] Estratto da wikipedia.org.
- Manuale di economia chimica, (2017). Acido solforico. Recuperato da ihs.com.
- Chemical Economics Handbook, (2017.) Consumo mondiale di acido solforico - 2013 [immagine]. Recuperato da ihs.com.
- ChemIDplus, (2017). Struttura 3D di 7664-93-9 - Acido solforico [immagine] Estratto da: chem.nlm.nih.gov.
- Codici Ashburnhamiani (1166). Ritratto di "Geber" del XV secolo. Biblioteca Laurenziana Medicea [immagine]. Estratto da wikipedia.org.
- Agenzia europea per le sostanze chimiche (ECHA), (2017). Riepilogo della classificazione e dell'etichettatura. Classificazione armonizzata - Allegato VI del Regolamento (CE) n. 1272/2008 (Regolamento CLP).
- Banca dati sulle sostanze pericolose (HSDB). TOXNET. (2017). Acido solforico. Bethesda, MD, UE: Biblioteca nazionale di medicina. Recupero da: toxnet.nlm.nih.gov.
- Leyo (2007) Formula scheletrica dell'acido solforico [immagine]. Estratto da: commons.wikimedia.org.
- Liebig's Extract of Meat Company (1929) Albertus Magnus, Chimistes Celebres [immagine]. Estratto da: wikipedia.org.
- Müller, H. (2000). Acido solforico e triossido di zolfo. Nell'Enciclopedia della chimica industriale di Ullmann. Wiley-VCH Verlag GmbH & Co. KGaA. Disponibile su: doi.org.
- Nazioni Unite (2015). Sesta edizione riveduta del sistema globale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS). New York, UE: pubblicazione delle Nazioni Unite. Estratto da: unece.org.
- Centro nazionale per le informazioni sulla biotecnologia. Database composto di PubChem, (2017). Acido solforico - Struttura di PubChem. [immagine] Bethesda, MD, EU: National Library of Medicine. Estratto da: pubchem.ncbi.nlm.nih.gov.
- Centro nazionale per le informazioni sulla biotecnologia. Database composto di PubChem, (2017). Acido solforico. Bethesda, MD, UE: Biblioteca nazionale di medicina. Estratto da: pubchem.ncbi.nlm.nih.gov.
- Amministrazione nazionale oceanica e atmosferica (NOAA). CAMEO Chemicals. (2017). Scheda tecnica chimica. Acido solforico, esaurito. Silver Spring, MD. UNIONE EUROPEA; Estratto da: cameochemicals.noaa.gov.
- Amministrazione nazionale oceanica e atmosferica (NOAA). CAMEO Chemicals. (2017). Scheda tecnica chimica. Acido solforico. Silver Spring, MD. UNIONE EUROPEA; Estratto da: cameochemicals.noaa.gov.
- Amministrazione nazionale oceanica e atmosferica (NOAA). CAMEO Chemicals. (2017). Scheda tecnica Reactive Group. Acidi, fortemente ossidanti. Silver Spring, MD. UNIONE EUROPEA; Estratto da: cameochemicals.noaa.gov.
- Oelen, W. (2011) Acido solforico al 96% extra puro [immagine]. Estratto da: wikipedia.org.
- Oppenheim, R. (1890). Schwefelsäurefabrik nach dem Bleikammerverfahren in der zweiten Hälfte des 19. Lehrbuch der Technischen Chemie [immagine]. Estratto da: wikipedia.org.
- Priesner, C. (1982) Johann Christian Bernhardt und die Vitriolsäure, in: Chemie in unserer Zeit. [immagine]. Estratto da: wikipedia.org.
- Stephanb (2006) Copper sulfate [immagine]. Estratto da: wikipedia.org.
- Stolz, D. (1614) Diagramma alchemico. Theatrum Chymicum [immagine] Estratto da: wikipedia.org.
- Wikipedia, (2017). Acido solforico. Estratto da: wikipedia.org.
- Wikipedia, (2017). Acido solforico. Estratto da: wikipedia.org.
- Wikipedia, (2017). Bleikammerverfahren. Estratto da: wikipedia.org.
- Wikipedia, (2017). Processo di contatto. Estratto da: wikipedia.org.
- Wikipedia, (2017). Processo della camera di piombo. Estratto da: wikipedia.org.
- Wikipedia, (2017). Oleum. Estratto da: https://en.wikipedia.org/wiki/Oleum
- Wikipedia, (2017). Oleum. Estratto da: https://es.wikipedia.org/wiki/%C3%93leum
- Wikipedia, (2017). Ossido di zolfo Estratto da: wikipedia.org.
- Wikipedia, (2017). Processo al vetriolo. Estratto da: wikipedia.org.
- Wikipedia, (2017). Diossido di zolfo. Estratto da: wikipedia.org.
- Wikipedia, (2017). Anidride solforica. Estratto da: wikipedia.org.
- Wikipedia, (2017). Acido solforico. Estratto da: wikipedia.org.
- Wikipedia, (2017). Vitriolverfahren. Estratto da: wikipedia.org.
- Wright, J. (1770) The Alchymist, In Search of the Philosopher's Stone, Discover Phosphorus, e prega per la conclusione positiva della sua operazione, come era consuetudine degli Ancient Chymical Astrologers. [immagine] Estratto da: wikipedia.org.



Nessun utente ha ancora commentato questo articolo.