
Struttura, proprietà, sintesi e usi del cicloesene
Il cicloesene è un alchene o olefina ciclico la cui formula molecolare è C6H10. È costituito da un liquido incolore, insolubile in acqua e miscibile con molti solventi organici. È caratterizzato dall'essere infiammabile e in natura si trova solitamente nel catrame di carbone.
Il cicloesene è sintetizzato per idrogenazione parziale del benzene e per disidratazione del cicloesanolo alcolico; cioè una forma più ossidata. Come altri cicloalcheni, subisce reazioni elettrofile e di addizione di radicali liberi; ad esempio, la reazione di alogenazione.

Questo alchene ciclico (immagine in alto) forma miscele azeotropiche (non separabili per distillazione), con alcoli inferiori e acido acetico. Non è molto stabile nello stoccaggio prolungato, poiché si decompone sotto l'azione della luce solare e dei raggi ultravioletti.
Il cicloesene è utilizzato come solvente, e quindi ha numerose applicazioni, come: stabilizzante di benzina ad alto numero di ottano e per l'estrazione di oli.
Ma la cosa più importante è che il cicloesene funge da intermedio e materia prima per ottenere numerosi composti altamente utili, tra cui: cicloesanone, acido adipico, acido maleico, cicloesano, butadiene, acido cicloesilcarbossilico, ecc..
Indice articolo
- 1 Struttura del cicloesene
- 1.1 Interazioni intermolecolari
- 2 Proprietà
- 2.1 Nomi chimici
- 2.2 Peso molecolare
- 2.3 Aspetto fisico
- 2.4 Odore
- 2.5 Punto di ebollizione
- 2.6 Punto di fusione
- 2.7 Punto di infiammabilità
- 2.8 Solubilità in acqua
- 2.9 Solubilità in solventi organici
- 2.10 Densità
- 2.11 Densità del vapore
- 2.12 Pressione di vapore
- 2.13 Autoaccensione
- 2.14 Decomposizione
- 2.15 Viscosità
- 2.16 Calore di combustione
- 2.17 Calore di vaporizzazione
- 2.18 Tensione superficiale
- 2.19 Polimerizzazione
- 2.20 Soglia di odore
- 2.21 Indice di rifrazione
- 2,22 pH
- 2.23 Stabilità
- 2.24 Reazioni
- 3 Sintesi
- 4 Usi
- 5 Rischi
- 6 Riferimenti
Struttura del cicloesene
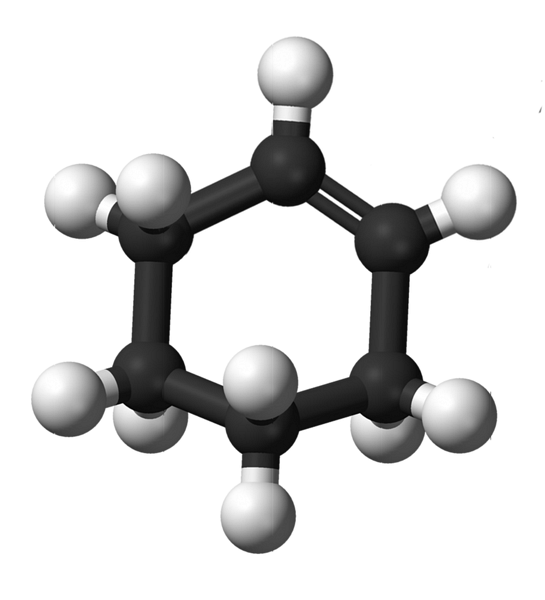
L'immagine in alto mostra la struttura del cicloesene con un modello di sfere e barre. Notare l'anello a sei atomi di carbonio e il doppio legame, entrambi insaturazioni del composto. Da questa prospettiva, sembra che l'anello sia piatto; ma non lo è affatto.
Per cominciare, i carboni del doppio legame hanno ibridazione spDue, che dà loro una geometria del piano trigonale. Pertanto, questi due atomi di carbonio e quelli ad essi adiacenti sono sullo stesso piano; mentre i due atomi di carbonio all'estremità opposta (al doppio legame), sono sopra e sotto detto piano.
L'immagine sotto illustra perfettamente quanto appena spiegato.

Nota che la banda nera è composta da quattro atomi di carbonio: i due del doppio legame e gli altri adiacenti. La prospettiva esposta è quella che si otterrebbe se uno spettatore ponesse l'occhio direttamente davanti al doppio legame. Si può quindi vedere che un carbonio è sopra e sotto questo piano.
Poiché la molecola di cicloesene non è statica, i due atomi di carbonio si scambieranno: uno scenderà mentre l'altro salirà sopra il piano. Quindi, ti aspetteresti che quella molecola si comporti.
Interazioni intermolecolari
Il cicloesene è un idrocarburo e quindi le sue interazioni intermolecolari si basano sulle forze di dispersione di Londra.
Questo perché la molecola è apolare, senza momento di dipolo permanente, e il suo peso molecolare è il fattore che più contribuisce a mantenerla coesa nel liquido..
Allo stesso modo, il doppio legame aumenta il grado di interazione, poiché non può muoversi con la stessa flessibilità di quella degli altri atomi di carbonio, e questo favorisce l'interazione tra molecole vicine. È per questo motivo che il cicloesene ha un punto di ebollizione leggermente superiore (83ºC) rispetto a quello del cicloesano (81ºC)..
Proprietà
Nomi chimici
Cicloesene, tetraidrobenzene.
Peso molecolare
82,146 g / mol.
Aspetto fisico
Liquido incolore.
Odore
Odore dolce.
Punto di ebollizione
83 ºC a 760 mmHg.
Punto di fusione
-103,5 ºC.
punto di accensione
-7 ºC (vaso chiuso).
Solubilità dell'acqua
Praticamente insolubile (213 mg / L).
Solubilità in solventi organici
Miscibile con etanolo, benzene, tetracloruro di carbonio, etere di petrolio e acetone. Si prevede che sia in grado di dissolvere i composti apolari, come alcuni degli allotropi del carbonio..
Densità
0,810 g / cm3 a 20ºC.
Densità del vapore
2.8 (relativo all'aria presa uguale a 1).
Pressione del vapore
89 mmHg a 25ºC.
Autoaccensione
244 ºC.
Decomposizione
Si decompone in presenza di sali di uranio, sotto l'azione della luce solare e dei raggi ultravioletti.
Viscosità
0,625 mPascal a 25 ºC.
Calore di combustione
3.751,7 kJ / mol a 25 ºC.
Calore di vaporizzazione
30,46 kJ / mol a 25 ºC.
Tensione superficiale
26,26 mN / m.
Polimerizzazione
Può polimerizzare in determinate condizioni.
Soglia di odore
0,6 mg / m3.
Indice di rifrazione
1,4465 a 20 ºC.
pH
7-8 a 20 ° C.
Stabilità
Il cicloesene non è molto stabile durante la conservazione a lungo termine. L'esposizione alla luce e all'aria può portare alla produzione di perossidi. Inoltre è incompatibile con forti agenti ossidanti..
Reazioni
-I cicloalcheni subiscono principalmente reazioni di addizione, sia elettrofile che con radicali liberi.
-Reagisce con il bromo per formare 1,2-dibromocicloesano.
-Si ossida rapidamente in presenza di permanganato di potassio (KMnO4).
-È in grado di produrre un epossido (ossido di cicloesene) in presenza di acido perossibenzoico.
Sintesi
Il cicloesene è prodotto dalla catalisi acida del cicloesanolo:
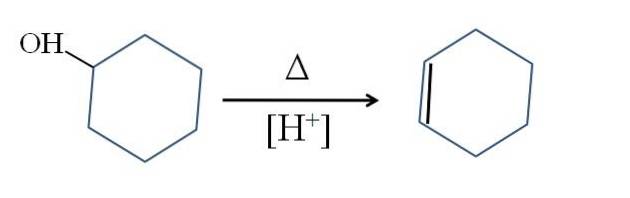
Il simbolo Δ rappresenta il calore necessario per favorire l'uscita del gruppo OH come molecola d'acqua in un mezzo acido (-OHDue+).
Il cicloesene è prodotto anche dalla parziale idrogenazione del benzene; cioè, due dei suoi doppi legami aggiungono una molecola di idrogeno:
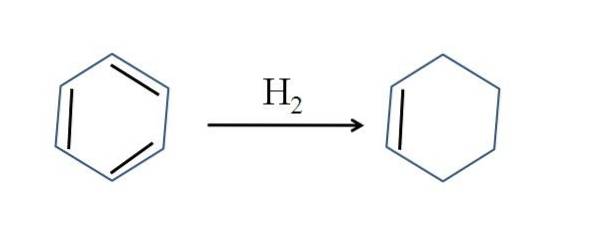
Sebbene la reazione sembri semplice, richiede grandi pressioni di H.Due e catalizzatori.
Applicazioni
-Ha utilità come solvente organico. Inoltre, è una materia prima per la produzione di acido adipico, aldeide adipica, acido maleico, cicloesano e acido cicloesilcarbossilico..
-Viene utilizzato nella produzione di cicloesano cloruro, un composto utilizzato come intermedio nella fabbricazione di prodotti farmaceutici e additivo di gomma.
-Il cicloesene è utilizzato anche nella sintesi del cicloesanone, una materia prima per la produzione di medicinali, pesticidi, profumi e coloranti..
-Il cicloesene è coinvolto nella sintesi dell'aminocicloesanolo, un composto utilizzato come tensioattivo ed emulsionante.
-Inoltre, il cicloesene può essere utilizzato per la preparazione in laboratorio del butadiene. Quest'ultimo composto viene utilizzato nella produzione di gomma sintetica, nella produzione di pneumatici per automobili e viene anche utilizzato nella produzione di materie plastiche acriliche..
-Il cicloesene è una materia prima per la sintesi di lisina, fenolo, resina policicloolefina e additivi di gomma.
-È usato come stabilizzante per benzina ad alto numero di ottano.
-Interviene nella sintesi di rivestimenti impermeabili, film resistenti alle crepe e leganti di incollaggio per rivestimenti.
Rischi
Il cicloesene non è un composto molto tossico, ma può causare arrossamento della pelle e degli occhi al contatto. L'inalazione può provocare tosse e sonnolenza. Inoltre, la sua ingestione può provocare sonnolenza, mancanza di respiro e nausea..
Il cicloesene è scarsamente assorbito dal tratto gastrointestinale, pertanto non sono attesi effetti sistemici gravi dall'ingestione. La massima complicanza è la sua aspirazione attraverso il sistema respiratorio, che può causare polmonite chimica.
Riferimenti
- Joseph F. Chiang e Simon Harvey Bauer. (1968). Struttura molecolare del cicloesene. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cicloesene: rischi, sintesi e struttura. Studia. Estratto da: study.com
- Morrison, R. T. e Boyd, R. N. (1987). Chimica organica. (5ta Edizione.). Editoriale Addison-Wesley Iberoamericana.
- PubChem. (2019). Cicloesene. Estratto da: pubchem.ncbi.nlm.nih.gov
- Libro chimico. (2019). Cicloesene. Estratto da: chemicalbook.com
- Rete di dati sulla tossicologia. (2017). Cicloesene. Toxnet. Recupero da: toxnet.nlm.nih.gov
- Chemoxy. (s.f.). La formula strutturale del cicloesene è. Estratto da: chemoxy.com



Nessun utente ha ancora commentato questo articolo.