
Proprietà, reazioni, usi, esempi dei cicloalcani

Il cicloalcani sono una famiglia di idrocarburi saturi con una formula generale di CnH2n che coincide con quello degli alcheni; con la differenza che l'apparente insaturazione non è dovuta ad un doppio legame, ma ad un anello o ciclo. Ecco perché sono considerati isomeri degli alcheni.
Questi si formano quando gli alcani lineari si uniscono alle estremità delle loro catene per creare una struttura chiusa. Come con gli alcani, i cicloalcani possono esibire diverse dimensioni, masse molecolari, sostituzioni o anche sistemi composti da più di un anello (policiclico).
Altrimenti, chimicamente e fisicamente sono simili agli alcani. Hanno solo carboni e idrogeni, sono molecole neutre e quindi interagiscono attraverso le forze di Van der Walls. Servono anche come combustibili, rilasciando calore quando bruciano in presenza di ossigeno..
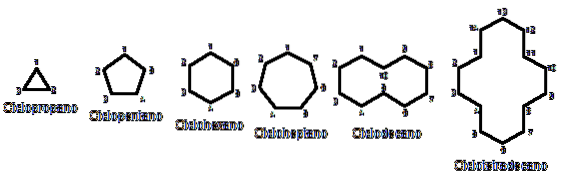
Perché i cicloalcani sono più instabili delle loro controparti a catena aperta? Il motivo può essere sospettato osservando a volo d'uccello gli esempi di cicloalcani rappresentati nell'immagine sopra: ci sono tensioni steriche (spaziali) e impedimenti.
Notare che meno atomi di carbonio ci sono (elencati in blu), più chiusa è la struttura; e il contrario accade quando aumentano, diventando come una collana.
I piccoli cicloalcani sono gassosi e, all'aumentare delle loro dimensioni, aumentano anche le loro forze intermolecolari. Di conseguenza, possono essere liquidi in grado di sciogliere grassi e molecole apolari, lubrificanti o solidi che presentano colori scuri e qualità come quelle dell'asfalto..
Indice articolo
- 1 Proprietà fisiche e chimiche
- 1.1 Polarità
- 1.2 Interazioni intermolecolari
- 1.3 Saturazione
- 1.4 Stabilità
- 2 Nomenclatura
- 3 Struttura
- 3.1 Conformazioni
- 4 Reazioni
- 5 Usi
- 6 Esempi di cicloalcani
- 7 Riferimenti
Proprietà fisiche e chimiche
Polarità
Essendo composto solo da carboni e idrogeni, atomi che di per sé non differiscono troppo in elettronegatività, questo fa sì che le molecole cicloalcano siano apolari e quindi prive di momento di dipolo.
Non possono interagire attraverso forze dipolo-dipolo, ma dipendono specificamente dalle forze di Londra, che sono deboli ma aumentano con la massa molecolare. Ecco perché i piccoli cicloalcani (con meno di cinque atomi di carbonio) sono gassosi..
Interazioni intermolecolari
D'altra parte, poiché sono anelli, i cicloalcani hanno un'area di contatto maggiore, che favorisce le forze di Londra tra le loro molecole. Pertanto, si raggruppano e interagiscono in modo migliore rispetto agli alcani; e quindi i suoi punti di ebollizione e di fusione sono più alti.
Inoltre, poiché hanno due atomi di idrogeno in meno (C.nH2n per cicloalcani e CnH2n + 2 per gli alcani), sono più leggeri; e aggiungendo a questo il fatto della sua maggiore area di contatto, il volume occupato dalle sue molecole diminuisce, e quindi sono più dense.
Saturazione
Perché i cicloalcani sono classificati come idrocarburi saturi? Perché non hanno un modo per incorporare una molecola di idrogeno; a meno che l'anello non venga aperto, nel qual caso diventerebbero semplici alcani. Affinché un idrocarburo sia considerato saturo, deve avere il numero massimo possibile di legami C-H.
Stabilità
Chimicamente sono molto simili agli alcani. Entrambi hanno legami C-C e C-H, che non sono così facili da rompere per produrre altri prodotti. Tuttavia, le loro stabilità relative differiscono, che possono essere verificate sperimentalmente misurando il loro calore di combustione (ΔHpettine).
Ad esempio, quando si confronta ΔHpettine per propano e ciclopropano (rappresentati da un triangolo nell'immagine), abbiamo rispettivamente 527,4 kcal / mol e 498,9 kcal / mol.
Il dettaglio è che il ciclopropano, basato sui calori di combustione degli alcani, dovrebbe avere un ΔHpettine inferiore (471 kcal / mol) perché sono tre gruppi metilenici, CHDue; ma in realtà rilascia più calore, riflettendo una maggiore instabilità di quanto stimato. Si dice che questa energia in eccesso sia dovuta alle sollecitazioni all'interno dell'anello..
E infatti queste tensioni governano e differenziano la reattività o stabilità dei cicloalcani, rispetto agli alcani, nei confronti di reazioni specifiche. Finché le sollecitazioni non sono molto elevate, i cicloalcani tendono ad essere più stabili dei loro rispettivi alcani..
Nomenclatura
La nomenclatura IUPAC per i cicloalcani non differisce molto da quella per gli alcani. La regola più semplice di tutte è posizionare il prefisso ciclo- al nome dell'alcano da cui è formato il cicloalcano.
Così, ad esempio, da n-esano, CH3CHDueCHDueCHDueCHDueCH3, si ottiene il cicloesano (rappresentato da un esagono nella prima immagine). Lo stesso accade con ciclopropano, ciclobutano, ecc..
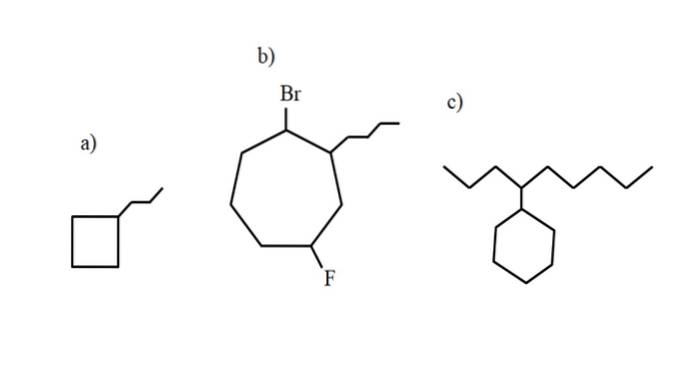
Tuttavia, questi composti possono subire sostituzioni di uno dei loro idrogeni. Quando il numero di atomi di carbonio nell'anello è maggiore di quello dei sostituenti alchilici, l'anello è considerato la catena principale; questo è il caso di a) per l'immagine sopra.
Si noti che in a) il ciclobutano (il quadrato) ha più atomi di carbonio del gruppo propile ad esso attaccato; quindi questo composto è chiamato propilciclobutano.
Se è presente più di un sostituente, è necessario denominarli in ordine alfabetico e in modo tale da avere il numero di localizzazione più basso possibile. Ad esempio, b) è chiamato: 1-bromo-4-fluoro-2-butilcicloeptano (e non 1-bromo-5-fluoro-7-butilcicloeptano, che sarebbe errato).
E infine, quando il sostituente alchilico ha più atomi di carbonio dell'anello, si dice che quest'ultimo sia il gruppo sostituente della catena principale. Quindi, c) è chiamato: 4-cicloesilnonano.
Struttura
Tralasciando i cicloalcani sostituiti, è conveniente concentrarsi solo sulle loro basi strutturali: gli anelli. Questi sono stati raffigurati nella prima immagine.
Osservarli può portare alla falsa idea che tali molecole siano piatte; ma ad eccezione del ciclopropano, le sue superfici sono a "zigzag", con atomi di carbonio che salgono o scendono rispetto allo stesso piano.
Questo perché tutti gli atomi di carbonio sono ibridizzati sp per cominciare.3, e quindi presentano geometrie tetraedriche con angoli di legame di 109,5º. Ma, se si osserva attentamente la geometria degli anelli, è impossibile che i loro angoli siano questi; ad esempio, gli angoli all'interno del triangolo del ciclopropano sono 60º.
Questo è ciò che è noto come stress angolare. Più grandi sono gli anelli, l'angolo tra i legami C-C è più vicino a 109,5º, il che provoca una diminuzione di detta tensione e un aumento della stabilità del cicloalcano..
Un altro esempio si osserva nel ciclobutano, i cui angoli di legame sono di 90º. Già nel ciclopentano i suoi angoli sono di 108º, e dal cicloesano si dice allora che la tensione angolare cessi di esercitare un così notevole effetto destabilizzante.
Conformazioni
Oltre allo stress angolare, ci sono altri fattori che contribuiscono allo stress sperimentato dai cicloalcani..
I legami C-C non possono semplicemente ruotare, poiché ciò implicherebbe che l'intera struttura "tremerebbe". Pertanto, queste molecole possono adottare conformazioni spaziali molto ben definite. Lo scopo di questi movimenti è ridurre gli stress causati dall'eclissi degli atomi di idrogeno; cioè quando sono uno di fronte all'altro.
Ad esempio, le conformazioni del ciclobutano ricordano una farfalla che sbatte le ali; quelli di ciclopentano, una busta; quelli del cicloesano, una barca o una sedia, e più grande è l'anello, maggiore è il numero e le forme che possono assumere nello spazio.
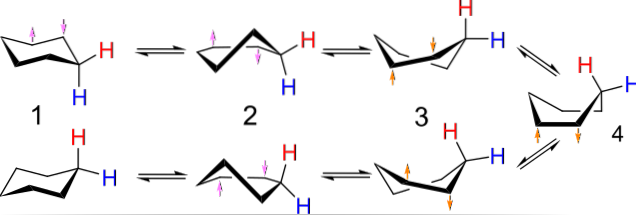
L'immagine sopra mostra un esempio di tali conformazioni per il cicloesano. Nota che il presunto esagono piatto sembra in realtà più una sedia (a sinistra dell'immagine) o una barca (a destra). Un idrogeno è rappresentato da una lettera rossa e un altro da una lettera blu, per indicare come cambiano le loro posizioni relative dopo le inversioni..
In (1), quando l'idrogeno è perpendicolare al piano dell'anello, si dice che sia nella posizione assiale; e quando è parallelo a questo, si dice che sia nella posizione equatoriale.
Reazioni
Le reazioni che possono subire i cicloalcani sono le stesse degli alcani. Entrambi bruciano in presenza di ossigeno in eccesso nelle tipiche reazioni di combustione per produrre anidride carbonica e acqua. Allo stesso modo, entrambi possono subire alogenazioni, in cui un idrogeno viene sostituito da un atomo di alogeno (F, Cl, Br, I).
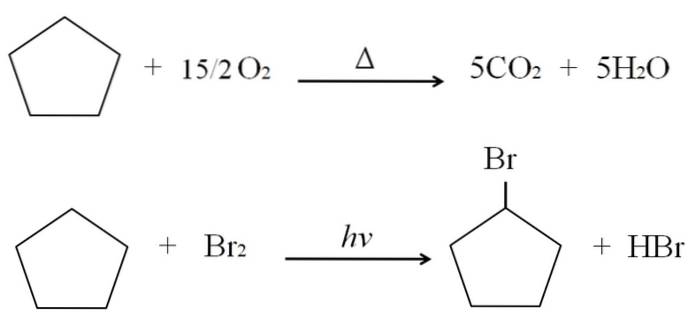
Le reazioni di combustione e di alogenazione per il ciclopentano sono mostrate sopra a titolo di esempio. Una mole di esso brucia in presenza di calore e 7,5 moli di ossigeno molecolare per decomporsi in CODue e H.DueO. D'altra parte, in presenza di radiazioni ultraviolette e bromo, sostituisce una H con una Br, rilasciando una molecola gassosa di HBr.
Applicazioni
L'uso dei cicloalcani dipende fortemente dal loro numero di carbonio. I più leggeri, e quindi gassosi, erano un tempo utilizzati per alimentare i lampioni a gas dell'illuminazione pubblica.
I liquidi, da parte loro, hanno utilità come solventi per oli, grassi o prodotti commerciali di natura non polare. Tra questi si possono citare ciclopentano, cicloesano e cicloeptano. Allo stesso modo, tendono ad essere utilizzati molto frequentemente nelle operazioni di routine nei laboratori petroliferi o nella formulazione di combustibili..
Se sono più pesanti, possono essere usati come lubrificanti. D'altra parte, possono anche rappresentare il materiale di partenza per la sintesi di farmaci; come il carboplatino, che include un anello ciclobutano nella sua struttura.
Esempi di cicloalcani
Infine, torniamo all'inizio dell'articolo: l'immagine con diversi cicloalcani non sostituiti.
Per memorizzare i cicloalcani, basti pensare alle figure geometriche: triangolo (ciclopropano), quadrato (ciclobutano), pentagono (ciclopentano), esagono (cicloesano), eptagono (cicloeptano), decagono (ciclodecano), pentadecagono (ciclopentadecano), e così via..
Più grande è l'anello, meno assomiglia alla sua rispettiva figura geometrica. Si è già visto che il cicloesano è tutt'altro che un esagono; lo stesso è più evidente con il ciclotetradecano (quattordici atomi di carbonio).
Arriva un punto in cui si comporteranno come collane che possono essere piegate per ridurre lo stress dei loro collegamenti e l'eclissi il più possibile..
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Chemistry LibreTexts. (02 giugno 2019). Denominazione dei cicloalcani. Recupero da: chem.libretexts.org
- Wikipedia. (2019). Cicloalcano. Estratto da: en.wikipedia.org
- Clark Jim. (2015). Presentazione di alcani e cicloalcani. Estratto da: chemguide.co.uk
- James Ashenhurst. (2019). Conformazioni e cicloalcani. Master in chimica organica. Estratto da: masterorganicchemistry.com
- Fernández Germán. (s.f.). Teoria dei cicloalcani. Chimica organica. Estratto da: quimicaorganica.org



Nessun utente ha ancora commentato questo articolo.