
Struttura, proprietà, usi del carbonato di alluminio

Il carbonato di alluminio è un sale inorganico la cui formula chimica è AlDue(CO3)3. È un carbonato metallico praticamente inesistente, data la sua elevata instabilità in condizioni normali..
Tra i motivi della sua instabilità possiamo citare le deboli interazioni elettrostatiche tra gli ioni Al3+ e CO3Due-, che in teoria dovrebbe essere molto forte a causa dell'entità delle loro cariche.
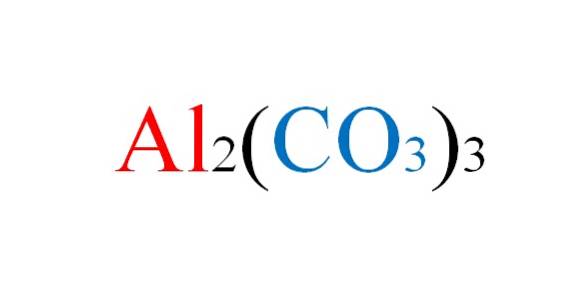
Il sale non deve affrontare alcun inconveniente sulla carta quando vengono scritte le equazioni chimiche delle sue reazioni; ma in pratica gli si rivolta contro.
Nonostante quanto detto, il carbonato di alluminio può presentarsi in compagnia di altri ioni, come accade con il minerale dawsonite. Inoltre, c'è un derivato in cui interagisce con l'ammoniaca acquosa. Per il resto è considerata una miscela tra Al (OH)3 e H.DueCO3; che è uguale a una soluzione effervescente con un precipitato bianco.
Questa miscela ha usi medicinali. Tuttavia, al sale puro, isolabile e manipolabile di AlDue(CO3)3, nessuna applicazione possibile nota; almeno non sotto pressione enorme o condizioni estreme.
Indice articolo
- 1 Struttura in carbonato di alluminio
- 1.1 Carbonato di idrossido di alluminio e ammonio
- 2 Proprietà
- 2.1 Massa molare
- 2.2 Instabilità
- 2.3 Fisico
- 3 usi
- 4 Riferimenti
Struttura in carbonato di alluminio
La struttura cristallina di questo sale è sconosciuta, perché è così instabile da non poter essere caratterizzato. Dalla sua formula AlDue(CO3)3, Tuttavia, è noto che la proporzione di ioni Al3+ e CO3Due- è 2: 3; cioè per ogni due cationi AlDue+ devono esserci tre anioni CO3Due- interagendo elettrostaticamente con loro.
Il problema è che entrambi gli ioni sono di dimensioni molto disuguali; l'Al3+ è molto piccolo mentre CO3Due- è ingombrante. Questa differenza di per sé influisce già sulla stabilità del reticolo del reticolo cristallino, i cui ioni interagirebbero "goffamente" se questo sale potesse essere isolato allo stato solido.
Oltre a questo aspetto, l'Al3+ è un catione altamente polarizzante, una proprietà che deforma la nuvola elettronica di CO3Due-. È come se volessi costringerlo a legarsi in modo covalente, anche se l'anione non può..
Di conseguenza, le interazioni ioniche tra Al3+ e CO3Due- tendono alla covalenza; un altro fattore che si aggiunge all'instabilità di AlDue(CO3)3.
Carbonato di idrossido di alluminio e ammonio
Il rapporto caotico tra gli Al3+ e CO3Due- si ammorbidisce in apparenza quando altri ioni sono presenti nel vetro; come NH4+ e OH-, da una soluzione di ammoniaca. Questo quartetto di ioni, Al3+, CO3Due-, NH4+ e OH-, riescono a definire cristalli stabili, anche capaci di adottare morfologie differenti.
Un altro esempio simile a questo si osserva nel minerale dawsonite e nei suoi cristalli ortorombici, NaAlCO3(OH)Due, dove il Na+ sostituisce NH4+. In questi sali, i loro legami ionici sono abbastanza forti che l'acqua non favorisce il rilascio di CO.Due; o almeno non bruscamente.
Sebbene l'NH4Al (OH)DueCO3 (AACC, per il suo acronimo in inglese), né NaAlCO3(OH)Due rappresentano carbonato di alluminio, possono essere considerati come loro derivati basici.
Proprietà
Massa molare
233,98 g / mol.
Instabilità
Nella sezione precedente, è stato spiegato da una prospettiva molecolare perché AlDue(CO3)3 è instabile. Ma quale trasformazione subisce? Ci sono due situazioni da considerare: una asciutta e l'altra "bagnata".
Asciutto
Nella situazione secca, l'anione CO3Due- ritorna a CODue dalla seguente decomposizione:
AlDue(CO3)3 => AlDueO3 + 3CODue
Il che ha senso se viene sintetizzato ad alta pressione di CO.Due; cioè la reazione inversa:
AlDueO3 + 3CODue => AlDue(CO3)3
Pertanto, per evitare che AlDue(CO3)3 il sale va sottoposto ad alta pressione (utilizzando NDue, per esempio). In questo modo la formazione di CODue non sarebbe termodinamicamente favorito.
Bagnato
Mentre nella situazione umida, il CO3Due- subisce l'idrolisi, che genera piccole quantità di OH-; ma sufficiente per far precipitare l'idrossido di alluminio, Al (OH)3:
CO3Due- + HDueO <=> HCO3- + Oh-
Al3+ + 3OH- <=> Al (OH)3
E d'altra parte, l'Al3+ idrolizza anche:
Al3+ + HDueO <=> Al (OH)DueDue+ + H+
Anche se l'Al si idraterebbe prima3+ per formare il complesso Al (HDueO)63+, che viene idrolizzato per dare [Al (HDueO)5OH]Due+ e H.3O+. Quindi l'H3O (o H+) protone a CO3Due- a HDueCO3, che si decompone a CODue e H.DueO:
CO3Due- + 2H+ => HDueCO3
HDueCO3 <=> CODue + HDueO
Si noti che alla fine l'Al3+ si comporta come un acido (rilascia H.+) e una base (rilascia OH- con l'equilibrio di solubilità di Al (OH)3); cioè, esibisce anfotericismo.
Fisico
Se può essere isolato, è probabile che questo sale sia di colore bianco, come molti altri sali di alluminio. Inoltre, a causa della differenza tra i raggi ionici di Al3+ e CO3Due-, avrebbe sicuramente punti di fusione o di ebollizione molto bassi rispetto ad altri composti ionici.
E per quanto riguarda la sua solubilità, sarebbe infinitamente solubile in acqua. Inoltre, sarebbe un solido igroscopico e deliquescente. Tuttavia, queste sono solo supposizioni. Altre proprietà dovrebbero essere stimate con modelli computerizzati sottoposti a pressioni elevate..
Applicazioni
Le applicazioni note del carbonato di alluminio sono mediche. Era usato come lieve astringente e come farmaco per trattare l'ulcera gastrica e l'infiammazione. È stato anche usato per prevenire la formazione di calcoli urinari negli esseri umani..
È stato utilizzato per controllare un aumento del contenuto di fosfato nel corpo e anche per trattare i sintomi di bruciore di stomaco, indigestione acida e ulcere gastriche..
Riferimenti
- XueHui L., Zhe T., YongMing C., RuiYu Z. e Chenguang L. (2012). Sintesi idrotermale di nanopiastrine di idrossido di carbonato di alluminio e ammonio (AACH) e morfologie a pH controllato di nanofibre. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Ammonio alluminio carbonato idrossido NH4Al (OH) 2CO3 come via alternativa per la preparazione dell'allumina: confronto con il classico precursore della boehmite. Tecnologia delle polveri, 320, 565-573, DOI: 10.1016 / j.powtec.2017.07.0080
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Carbonato di alluminio. Database PubChem., CID = 10353966. Estratto da: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Carbonato di alluminio. Estratto da: en.wikipedia.org
- Solfato di alluminio. (2019). Carbonato di alluminio. Estratto da: aluminiumsulfate.net



Nessun utente ha ancora commentato questo articolo.