
Storia del calorimetro, parti, tipi e loro caratteristiche
Il calorimetro è un dispositivo utilizzato per misurare la variazione di temperatura di una quantità di sostanza (solitamente acqua) di calore specifico noto. Questa variazione di temperatura è dovuta al calore assorbito o rilasciato nel processo in esame; chimica se è una reazione, o fisica se consiste in una fase o in un cambiamento di stato.
In laboratorio il calorimetro più semplice che si può trovare è quello del bicchiere da caffè. Viene utilizzato per misurare il calore assorbito o rilasciato in una reazione a pressione costante, in soluzione acquosa. Le reazioni sono selezionate per evitare l'intervento di reagenti o prodotti gassosi.
Quantità di calore emessa nella reazione = quantità di calore assorbita dal calorimetro + quantità di calore assorbita dalla soluzione
La quantità di calore assorbita dal calorimetro è chiamata capacità calorimetrica del calorimetro. Questo è determinato fornendo una quantità nota di calore al calorimetro con una data massa d'acqua. Quindi, l'aumento della temperatura del calorimetro e della soluzione contenente.
Con questi dati, e utilizzando il calore specifico dell'acqua (4,18 J / g.ºC), si può calcolare la capacità calorica del calorimetro. Questa capacità è anche chiamata costante del calorimetro.
D'altra parte, il calore guadagnato dalla soluzione acquosa è pari a m · ce · Δt. Nella formula m = massa d'acqua, ce = calore specifico dell'acqua e Δt = variazione di temperatura. Sapendo tutto ciò, è quindi possibile calcolare la quantità di calore rilasciata dalla reazione esotermica.
Indice articolo
- 1 Storia del calorimetro
- 2 parti
- 3 tipi e loro caratteristiche
- 3.1 Il bicchiere di caffè
- 3.2 La bomba calorimetrica
- 3.3 Il calorimetro adiabatico
- 3.4 Il calorimetro isoperibol
- 3.5 Il calorimetro a flusso
- 3.6 Il calorimetro per la calorimetria a scansione differenziale
- 4 Applicazioni
- 4.1 In fisicochimica
- 4.2 Nei sistemi biologici
- 4.3 Calorimetro e potere calorico della pompa dell'ossigeno
- 5 Riferimenti
Storia del calorimetro
Nel 1780, A. L. Lavoisier, un chimico francese, considerato uno dei padri della chimica, usò una cavia per misurare la produzione di calore dalla sua respirazione.
Come? Utilizzando un dispositivo simile a un calorimetro. Il calore prodotto dalla cavia è stato evidenziato dallo scioglimento della neve che circondava l'apparato.
I ricercatori A. L Lavoisier (1743-1794) e P. S. Laplace (1749-1827) hanno progettato un calorimetro che è stato utilizzato per misurare il calore specifico di un corpo con il metodo dello scioglimento del ghiaccio.
Il calorimetro era costituito da una tazza cilindrica di latta verniciata, sostenuta da un treppiede e terminata internamente con un imbuto. Al suo interno era posto un altro bicchiere, simile al precedente, con un tubo che attraversava la camera esterna e che era provvisto di chiave. All'interno del secondo bicchiere c'era una griglia.
L'essere o l'oggetto il cui calore specifico doveva essere determinato veniva posto su questa griglia. Il ghiaccio è stato posto all'interno dei bicchieri concentrici, come nel cesto.
Il calore prodotto dal corpo è stato assorbito dal ghiaccio, facendolo sciogliere. E 'stata raccolta l'acqua liquida prodotta dallo scioglimento del ghiaccio, aprendo il rubinetto interno in vetro.
E infine, l'acqua pesava, la massa del ghiaccio fuso era nota.
Parti
Il calorimetro più utilizzato nei laboratori didattici di chimica è il cosiddetto calorimetro a tazza da caffè. Questo calorimetro è costituito da un bicchiere, o invece, un contenitore di materiale anime che ha determinate proprietà isolanti. All'interno di questo contenitore la soluzione acquosa viene posta con il corpo che produrrà o assorbirà calore.
Sulla parte superiore del contenitore è posto un coperchio in materiale isolante con due fori. In una è inserito un termometro per misurare le variazioni di temperatura, e nell'altra un agitatore, preferibilmente in materiale di vetro, che assolve alla funzione di spostare il contenuto della soluzione acquosa..
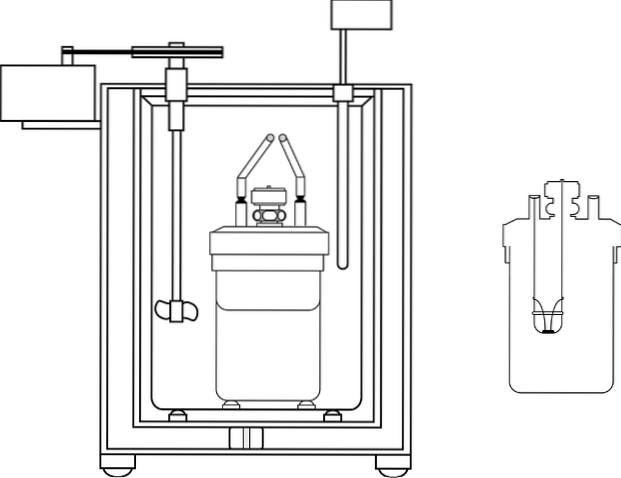
L'immagine mostra le parti del calorimetro di una bomba; Tuttavia, si può vedere che ha il termometro e l'agitatore, elementi comuni in diversi calorimetri.
Tipi e loro caratteristiche
La tazza di caffè
È quello che viene utilizzato nella determinazione del calore rilasciato da una reazione esotermica e del calore assorbito in una reazione endotermica..
Inoltre, può essere utilizzato per determinare il calore specifico di un corpo; cioè, la quantità di calore che un grammo della sostanza deve assorbire per aumentare la sua temperatura di un grado Celsius. .
La bomba calorimetrica
È un dispositivo in cui viene misurata la quantità di calore emessa o assorbita in una reazione che avviene a volume costante.
La reazione avviene in un robusto contenitore di acciaio (la pompa), che viene immerso in un grande volume d'acqua. Ciò mantiene i cambiamenti di temperatura dell'acqua piccoli. Pertanto, si presume che i cambiamenti associati alla reazione siano misurati a volume e temperatura costanti..
Quanto sopra indica che non viene svolto alcun lavoro quando viene eseguita una reazione nel calorimetro di una bomba.
La reazione inizia fornendo elettricità tramite cavi collegati alla pompa.
Il calorimetro adiabatico
È caratterizzato dall'avere una struttura isolante chiamata scudo. Lo schermo si trova intorno alla cella dove si verificano cambiamenti di calore e temperatura. Allo stesso modo, è collegato a un sistema elettronico che mantiene la sua temperatura molto vicina a quella della cella, per evitare il trasferimento di calore..
In un calorimetro adiabatico la differenza di temperatura tra il calorimetro e l'ambiente circostante è ridotta al minimo; oltre a ridurre al minimo il coefficiente di scambio termico e il tempo per lo scambio termico.
Le sue parti sono costituite da quanto segue:
-La cella (o contenitore), integrata in un sistema di isolamento mediante il quale cerca di evitare dispersioni termiche.
-Il termometro, per misurare le variazioni di temperatura.
-Un riscaldatore, collegato a una fonte di tensione elettrica controllabile.
-E lo scudo, già accennato.
In questo tipo di calorimetro, è possibile determinare proprietà come l'entropia, la temperatura di Debye e la densità elettronica di stato..
Il calorimetro dell'isoperibolo
È un dispositivo in cui la cella di reazione e la pompa sono immerse in una struttura chiamata camicia. In questo caso, la cosiddetta giacca è costituita da acqua, mantenuta a temperatura costante.
Le temperature della cella e della pompa aumentano quando il calore viene rilasciato durante il processo di combustione; ma la temperatura della camicia d'acqua è mantenuta a una temperatura fissa.
Un microprocessore controlla la temperatura della cella e della camicia, apportando le necessarie correzioni per la dispersione termica che risulta dalle differenze tra le due temperature..
Queste correzioni vengono applicate continuamente e con una correzione finale, basata sulle misurazioni prima e dopo il test..
Il calorimetro a flusso
Sviluppato da Caliendar, ha un dispositivo per spostare un gas in un contenitore a velocità costante. Aggiungendo calore, viene misurato l'aumento della temperatura nel fluido.
Il calorimetro a flusso è caratterizzato da:
- Una misurazione accurata della velocità di flusso costante.
- Misurazione accurata della quantità di calore introdotta al fluido attraverso un riscaldatore.
- Una misurazione accurata dell'aumento di temperatura del gas causato dall'energia immessa
- Un progetto per misurare la capacità di un gas sotto pressione.
Il calorimetro per la calorimetria a scansione differenziale
Si caratterizza per avere due contenitori: in uno viene posto il campione da studiare, mentre nell'altro viene mantenuto vuoto oppure viene utilizzato un materiale di riferimento..
I due vasi sono riscaldati a un tasso di energia costante, per mezzo di due riscaldatori indipendenti. Quando i due vasi iniziano a riscaldarsi, il computer traccia la differenza di flusso di calore dai riscaldatori rispetto alla temperatura, consentendo così di determinare il flusso di calore..
Inoltre si può determinare la variazione della temperatura in funzione del tempo; e infine, la capacità calorica.
Applicazioni
In fisicochimica
-I calorimetri di base, tipo tazzina, permettono di misurare la quantità di calore che un corpo emana o assorbe. In essi è possibile determinare se una reazione è esotermica o endotermica. Inoltre, è possibile determinare il calore specifico di un corpo.
-Con il calorimetro adiabatico è stato possibile determinare l'entropia di un processo chimico e la densità elettronica dello stato.
Nei sistemi biologici
-I microcalorimetri vengono utilizzati per studiare i sistemi biologici che includono le interazioni tra le molecole, nonché i cambiamenti conformazionali molecolari che si verificano; per esempio, nel dispiegarsi di una molecola. La linea include sia lo sweep differenziale che la titolazione isotermica.
-Il microcalorimetro viene utilizzato nello sviluppo di farmaci a piccole molecole, bioterapici e vaccini.
Calorimetro e potere calorico della pompa dell'ossigeno
Nel calorimetro della bomba all'ossigeno, avviene la combustione di numerose sostanze e il suo valore calorico può essere determinato. Tra le sostanze studiate utilizzando questo calorimetro ci sono: carbone e coke; oli commestibili, sia pesanti che leggeri; benzina e tutti i carburanti.
Così come i tipi di combustibili per reattori aeronautici; rifiuti di carburante e smaltimento dei rifiuti; prodotti alimentari e integratori per l'alimentazione umana; colture foraggere e integratori per l'alimentazione animale; Materiali di costruzione; combustibili per razzi e propellenti.
Allo stesso modo, il potere calorico è stato determinato dalla calorimetria in studi termodinamici di materiali combustibili; nello studio del bilancio energetico in ecologia; negli esplosivi e nelle polveri termiche e nell'insegnamento dei metodi termodinamici di base.
Riferimenti
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). CENGAGE Apprendimento.
- González J., Cortés L. e Sánchez A. (s.f.). Calorimetria adiabatica e sue applicazioni. Estratto da: cenam.mx
- Wikipedia. (2018). Calorimetro. Estratto da: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22 giugno 2018). Definizione di calorimetro in chimica. Estratto da: thoughtco.com
- Gillespie, Claire. (11 aprile 2018). Come funziona un calorimetro? Scienza. Estratto da: sciencing.com



Nessun utente ha ancora commentato questo articolo.