
Concetto sensibile al calore, formule ed esercizi risolti
Il calore sensibile è l'energia termica fornita ad un oggetto facendogli aumentare la sua temperatura. È l'opposto del calore latente, in cui l'energia termica non aumenta la temperatura ma anzi favorisce un cambio di fase, ad esempio da solido a liquido..
Un esempio chiarisce il concetto. Supponiamo di avere una pentola d'acqua a temperatura ambiente di 20 ° C. Quando lo mettiamo sul fornello, il calore fornito aumenta la temperatura dell'acqua lentamente fino a raggiungere i 100 ° C (temperatura di ebollizione dell'acqua a livello del mare). Il calore fornito è chiamato calore sensibile.

Una volta che l'acqua raggiunge il punto di ebollizione, il calore fornito dal bruciatore non innalza più la temperatura dell'acqua, che rimane a 100 ° C. In questo caso l'energia termica fornita viene investita nell'evaporazione dell'acqua. Il calore erogato è latente perché non ha innalzato la temperatura, ma ha invece provocato un passaggio dalla fase liquida a quella gassosa.
È un fatto sperimentale che il calore sensibile necessario per ottenere una certa variazione di temperatura è direttamente proporzionale a quella variazione e alla massa dell'oggetto..
Indice articolo
- 1 Concetto e formule
- 1.1 Il coefficiente adiabatico γ
- 1.2 Capacità termica C
- 1.3 Calore specifico in solidi, liquidi e gas
- 2 Differenza con il calore latente
- 2.1 Come calcolare il calore latente?
- 3 esercizi risolti
- 3.1 Esempio 1
- 3.2 Esempio 2
- 3.3 Esempio 3
- 4 Riferimenti
Concetto e formule
È stato osservato che, oltre alla massa e alla differenza di temperatura, il calore sensibile dipende anche dal materiale. Per questo motivo, la costante di proporzionalità tra il calore sensibile e il prodotto della massa e la differenza di temperatura è chiamata calore specifico.
La quantità di calore sensibile fornito dipende anche da come viene eseguito il processo. Ad esempio, è diverso se il processo viene eseguito a volume costante rispetto a pressione costante.
La formula per il calore sensibile in un processo isobarico, cioè, a pressione costante, è il seguente:
Q = cp . m (TF - Tio)
Nell'equazione precedente Q è il calore sensibile fornito all'oggetto massa m, che ha alzato la sua temperatura iniziale Tio fino al valore finale Tf. Nell'equazione sopra appare anche cp, che è il calore specifico del materiale a pressione costante perché il processo è stato eseguito in questo modo.
Si noti inoltre che il calore sensibile è positivo quando viene assorbito dall'oggetto e provoca un aumento della temperatura..
Nel caso in cui il calore venga fornito a un gas racchiuso in un contenitore rigido, il processo sarà isocorico, cioè a volume costante; e la formula per il calore sensibile sarà scritta così:
Q = cv. m. (TF - Tio)
Il coefficiente adiabatico γ
Viene chiamato il quoziente tra il calore specifico a pressione costante e il calore specifico a volume costante per lo stesso materiale o sostanza coefficiente adiabatico, che di solito è indicato dalla lettera greca gamma γ.
Il coefficiente adiabatico è maggiore dell'unità. Il calore richiesto per aumentare la temperatura di un corpo di un grammo di massa di un grado è maggiore in un processo isobarico che in uno isocoro..
Questo perché nel primo caso parte del calore viene utilizzato per svolgere lavori meccanici.
Oltre al calore specifico, spesso viene definita anche la capacità termica di un corpo. Questa è la quantità di calore necessaria per aumentare la temperatura di quel corpo di un grado centigrado.
Capacità termica C
La capacità termica è indicata da C lettera maiuscola, mentre il calore specifico con c minuscolo. La relazione tra entrambe le quantità è:
C = c⋅ m
Dove m è la massa del corpo.
Viene anche utilizzato il calore specifico molare, che è definito come la quantità di calore sensibile necessaria per aumentare la temperatura di una mole di sostanza di un grado Celsius o Kelvin..
Calore specifico in solidi, liquidi e gas
Il calore specifico molare della maggior parte dei solidi ha un valore vicino a 3 volte R, dove R è la costante universale dei gas. R = 8,314472 J / (mol ℃).
Ad esempio, l'alluminio ha un calore specifico molare 24,2 J / (mol ℃), Rame 24,5 J / (mol ℃), oro 25,4 J / (mol ℃), e il dolce ferro 25,1 J / (mol ℃). Notare che questi valori sono vicini a 3R = 24,9 J / (mol ℃).
Al contrario, per la maggior parte dei gas il calore specifico molare è vicino a n (R / 2), dove si trova n un numero intero e R è la costante universale dei gas. L'intero numero n è correlato al numero di gradi di libertà della molecola che compone il gas.
Ad esempio, in un gas ideale monoatomico, la cui molecola ha solo i tre gradi di libertà traslazionali, il calore specifico molare a volume costante è 3 (R / 2). Ma se è un gas ideale biatomico, ci sono anche due gradi di rotazione, quindi cv = 5 (R / 2).
Nei gas ideali, vale la seguente relazione tra calore specifico molare a pressione costante e volume costante: cp = cv + R.
Una menzione speciale merita l'acqua. Allo stato liquido a 25 ℃ l'acqua ha cp = 4,1813 J / (g ℃), il vapore acqueo a 100 gradi centigradi ha cp = 2.080 J / (g ℃) e l'acqua ghiacciata a zero gradi centigradi ha cp = 2.050 J / (g ℃).
Differenza con il calore latente
La materia può essere in tre stati: solido, liquido e gas. L'energia è necessaria per cambiare stato, ma ogni sostanza le risponde in modo diverso a seconda delle sue caratteristiche molecolari e atomiche..
Quando un solido si sta sciogliendo o un liquido sta evaporando, la temperatura dell'oggetto rimane costante fino a quando tutte le particelle non hanno cambiato il loro stato..
Per questo motivo, è possibile che una sostanza sia in equilibrio in due fasi: solido - liquido o liquido - vapore, per esempio. Una quantità della sostanza può passare da uno stato all'altro aggiungendo o togliendo un po 'di calore, mentre la temperatura rimane fissa..
Il calore fornito a un materiale fa vibrare più velocemente le sue particelle e aumenta la loro energia cinetica. Ciò si traduce in un aumento della temperatura.
È possibile che l'energia che acquisiscono sia così grande da non tornare più alla loro posizione di equilibrio e la separazione tra di loro aumenta. Quando ciò accade la temperatura non aumenta, ma la sostanza passa da solida a liquida o da liquida a gassosa.
Il calore necessario perché ciò avvenga è noto come Calore latente. Pertanto, il calore latente è il calore mediante il quale una sostanza può cambiare fase.
Ecco la differenza con il calore sensibile. Una sostanza che assorbe il calore sensibile aumenta la sua temperatura e rimane nello stesso stato.
Come calcolare il calore latente?
Il calore latente è calcolato dall'equazione:
Q = m. L
Dove L può essere il calore specifico di vaporizzazione o il calore di fusione. Le unità di L sono energia / massa.
Gli scienziati hanno dato al calore numerosi nomi, a seconda del tipo di reazione a cui partecipa. Ad esempio, c'è il calore di reazione, il calore di combustione, il calore di solidificazione, il calore di soluzione, il calore di sublimazione e molti altri..
I valori di molti di questi tipi di calore per diverse sostanze sono tabulati.
Esercizi risolti
Esempio 1
Supponiamo che uno abbia un pezzo di alluminio di 3 kg di massa. Inizialmente è a 20 ° C e si vuole aumentare la sua temperatura a 100 ° C. Calcola il calore sensibile richiesto.
Soluzione
Per prima cosa dobbiamo conoscere il calore specifico dell'alluminio
cp = 0,897 J / (g ° C)
Quindi la quantità di calore necessaria per riscaldare il pezzo di alluminio sarà
Q = cp m (Tf - Ti) = 0,897 * 3000 * (100-20) J
Q = 215280 J
Esempio 2
Calcola la quantità di calore necessaria per riscaldare 1 litro d'acqua da 25 ° C a 100 ° C a livello del mare. Esprimi il risultato anche in chilocalorie.
Soluzione
La prima cosa da ricordare è che 1 litro d'acqua pesa 1 kg, cioè 1000 grammi.
Q = cp m (Tf - Ti) = 4,1813 J / (g ℃) * 1000 g * (100 ℃ - 25 ℃) = 313597,5 J
La caloria è un'unità di energia definita come il calore sensibile necessario per sollevare un grammo d'acqua di un grado Celsius. Pertanto, 1 caloria equivale a 4,1813 Joule.
Q = 313597,5 J * (1 cal / 4,1813 J) = 75000 cal = 75 kcal.
Esempio 3
Un pezzo di materiale da 360,16 grammi viene riscaldato da 37 ℃ a 140 ℃. L'energia termica fornita è di 1150 calorie.
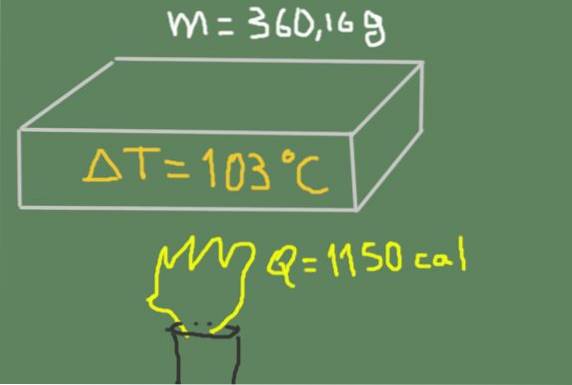
Trova il calore specifico del materiale.
Soluzione
Possiamo scrivere il calore specifico in funzione del calore sensibile, della massa e della variazione della temperatura secondo la formula:
cp = Q / (m ΔT)
Sostituendo i dati abbiamo quanto segue:
cp = 1150 cal / (360,16 g * (140 ℃ - 37 ℃)) = 0,0310 cal / (g ℃)
Ma poiché una caloria equivale a 4,1813 J, il risultato può anche essere espresso come
cp = 0,130 J / (g ℃)
Riferimenti
- Giancoli, D. 2006. Fisica: principi con applicazioni. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fisica: uno sguardo al mondo. 6ta Edizione abbreviata. Cengage Learning. 156 - 164.
- Tippens, P. 2011. Fisica: concetti e applicazioni. 7 °. Edizione rivisitata. McGraw Hill. 350 - 368.
- Rex, A. 2011. Fondamenti di fisica. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Fisica universitaria con fisica moderna. 14th. Volume 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Fondamenti di fisica. 9n / A Cengage Learning. 362 - 374.



Nessun utente ha ancora commentato questo articolo.