
Formule date a caldo, come calcolarlo ed esercizi risolti
Il calore ceduto è il trasferimento di energia tra due corpi a diverse temperature. Quello con la temperatura più alta cede calore a quello la cui temperatura è più bassa. Se un corpo cede o assorbe calore, la sua temperatura o il suo stato fisico può variare a seconda della massa e delle caratteristiche del materiale di cui è composto..
Un buon esempio è in una tazza di caffè fumante. Il cucchiaio di metallo con cui viene mescolato lo zucchero si riscalda. Se viene lasciato nella tazza abbastanza a lungo, il caffè e un cucchiaio di metallo finiranno per equalizzarne la temperatura: il caffè si sarà raffreddato e il cucchiaio avrà dato calore. Un po 'di calore sarà passato nell'ambiente, poiché il sistema non è isolato.

Quando le temperature si sono stabilizzate, il equilibrio termale.
Se facessi lo stesso test con un cucchiaino di plastica, noterai sicuramente che non si riscalda velocemente come quello di metallo, ma alla fine entrerà in equilibrio anche con il caffè e tutto ciò che lo circonda..
Questo perché il metallo conduce il calore meglio della plastica. D'altra parte, sicuramente il caffè cede calore a una velocità diversa dalla cioccolata calda o da altre bevande. Quindi il calore dato o assorbito da ogni oggetto dipende dal materiale o dalla sostanza di cui è composto..
Indice articolo
- 1 In cosa consiste e formule
- 1.1 La differenza di temperatura ΔT
- 1.2 Calore specifico e capacità termica di una sostanza
- 2 Come calcolarlo?
- 2.1 Calorimetria
- 3 esercizi risolti
- 3.1 Esercizio 1
- 3.2 Esercizio 2
- 4 Riferimenti
In cosa consiste e formule
Il calore si riferisce sempre al flusso o al transito di energia tra un oggetto e l'altro, a causa della differenza di temperatura.
Ecco perché parliamo di calore trasferito o calore assorbito, poiché aggiungendo o estraendo in qualche modo calore o energia, è possibile modificare la temperatura di un elemento.
La quantità di calore emessa dall'oggetto più caldo è solitamente chiamata Q. Questo valore è proporzionale alla massa di detto oggetto. Un corpo con una massa grande è in grado di cedere più calore di un altro con una massa inferiore..
Differenza di temperatura ΔT
Un altro fattore importante nel calcolo del calore rilasciato è la differenza di temperatura subita dall'oggetto che rilascia il calore. È indicato come ΔT ed è calcolato in questo modo:
ΔT = TF - To
Infine, la quantità di calore trasferita dipende anche dalla natura e dalle caratteristiche dell'oggetto, che vengono riassunte quantitativamente in una costante denominata calore specifico del materiale, indicato come c.
Quindi, infine, l'espressione per il calore trasferito è la seguente:
Qceduto = - m.c.ΔT
L'arrendersi è simboleggiato da un segno negativo.
Calore specifico e capacità termica di una sostanza
Il calore specifico è la quantità di calore necessaria per aumentare la temperatura di 1 g di sostanza di 1 ºC. È una proprietà intrinseca del materiale. Le sue unità nel Sistema Internazionale sono: Joule / kg. K (Joule tra chilogrammo x temperatura in gradi Kelvin).
La capacità termica C è un concetto collegato, ma leggermente diverso, poiché è coinvolta la massa dell'oggetto. La capacità termica è definita come segue:
C = mc
Le sue unità a S.I. sono Joule / K. Quindi il calore rilasciato può anche essere espresso in modo equivalente come:
Q = -C. ΔT
Come calcolarlo?
Per calcolare il calore sprigionato da un oggetto è necessario conoscere quanto segue:
- Il calore specifico della sostanza che cede il calore.
- La massa di detta sostanza
- La temperatura finale da ottenere
I valori termici specifici per molti materiali sono stati determinati sperimentalmente e sono disponibili nelle tabelle.
Calorimetria
Ora, se questo valore non è noto, è possibile ottenerlo con l'ausilio di un termometro e dell'acqua in un contenitore termoisolato: il calorimetro. Un diagramma di questo dispositivo è mostrato nella figura che accompagna l'esercizio 1.
Un campione della sostanza a una certa temperatura viene immerso in una quantità di acqua precedentemente misurata. Si misura la temperatura finale e si determina il calore specifico del materiale con i valori ottenuti..
Confrontando il risultato con i valori tabulati, è possibile sapere di quale sostanza si tratta. Questa procedura è chiamata calorimetria.
Il bilancio termico viene effettuato risparmiando energia:
Q ceduto + Q assorbito = 0
Esercizi risolti
Esercizio 1
Si introduce un pezzo di rame da 0,35 kg a una temperatura di 150ºC in 500 mL di acqua a una temperatura di 25ºC. Trova:
a) La temperatura di equilibrio finale
b) Quanto calore fluisce in questo processo?
Dati
crame = 385 J / kg. ºC
cacqua = 4180 J / kg. ºC
Densità dell'acqua: 1000 kg / m3
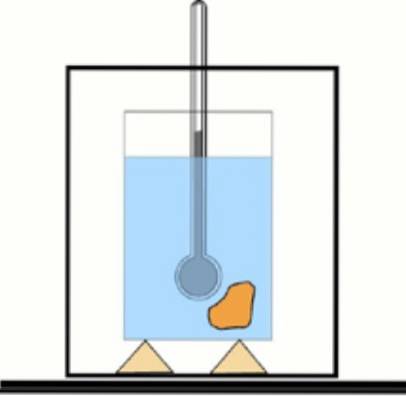
Soluzione
a) Il rame cede calore mentre l'acqua lo assorbe. Poiché il sistema è considerato chiuso, solo l'acqua e il campione intervengono nel bilancio termico:
Q ceduto = Q assorbito
D'altra parte, è necessario calcolare la massa di 500 mL di acqua:
500 mL = 0,5 L = 0,0005 m3
Con questi dati si calcola la massa dell'acqua:
massa = densità x volume = 1000 kg / m3 . 0.0005 m3 = 0,5 kg
Viene sollevata l'equazione per il calore in ciascuna sostanza:
Qceduto = -mrame . crame. ΔT = -0,35 kg. 385 J / kg. ° C . (TF -150 ºC) = -134,75 (TF - 150) J
Qassorbito = macqua . cacqua. ΔT = 0,5 kg. 4186 J / kg. ºC. (TF -25 ºC) = 2093 (TF -25) J
Paragonando i risultati, abbiamo:
2093 (TF - 25) = -134,75 (TF - 150)
È un'equazione lineare con uno sconosciuto, la cui soluzione è:
TF = 32,56 ºC
b) La quantità di calore che fluisce è il calore trasferito o il calore assorbito:
Q ceduto = - 134,75 (32,56 - 150) J = 15823 J
Q assorbito = 2093 (32,56 - 25) J = 15823 J
Esercizio 2
Un pezzo di rame da 100 g viene riscaldato in un forno a una temperatura To e poi si introduce in un calorimetro di rame da 150 g contenente 200 g di acqua a 16ºC. La temperatura finale una volta in equilibrio è di 38ºC. Quando si pesano il calorimetro e il suo contenuto, si scopre che sono evaporati 1,2 g di acqua. la temperatura iniziale To?
Dati: il calore latente di vaporizzazione dell'acqua è L.v = 2257 kJ / kg
Soluzione
Questo esercizio differisce dal precedente, poiché bisogna considerare che il calorimetro assorbe anche il calore. Il calore rilasciato dal pezzo di rame viene investito in tutto quanto segue:
- Riscaldare l'acqua nel calorimetro (200 g)
- Riscaldare il rame da cui è composto il calorimetro (150 g)
- Evaporare 1,2 grammi di acqua (l'energia è necessaria anche per un cambio di fase).
Qceduto = -100 X 1 x 10 -3 kg. 385 J / kg. ºC. (38 - To ) ºC = -38.5. (38 - To) J
Q assorbito da calorimetro = Q assorbito dall'acqua + Q vaporizzazione + Q assorbito dal rame
0,2 kg .4186 J / kg ºC. (38-16 ºC) + 1,2 x 10-3 kg. 2257000 J / kg +0,150 kg .385 J / kg .ºC. (38-16 ºC) =
18418,4 +2708,4 + 1270,5 J = 22397,3 J
Perciò:
-38.5. (38 - To) = 22397,3
To = 619,7 ºC
Si poteva anche considerare il calore necessario per portare 1,2 g di acqua fino a 100 ° C, ma in confronto è una quantità piuttosto piccola..
Riferimenti
- Giancoli, D. 2006. Fisica: principi con applicazioni. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fisica: uno sguardo al mondo. 6ta Edizione abbreviata. Cengage Learning. 156 - 164.
- Rex, A. 2011. Fondamenti di fisica. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Fisica universitaria con fisica moderna. 14th. Ed. Volume 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Fondamenti di fisica. 9n / A Cengage Learning.



Nessun utente ha ancora commentato questo articolo.