
Struttura butanale, proprietà, usi e rischi
Il butanal è un'aldeide a catena aperta, composta da quattro atomi di carbonio, ed è analoga al butano; è infatti la seconda forma più ossidata dell'idrocarburo butano dopo l'acido butirrico. La sua formula molecolare è CH3CHDueCHDueCHO, dove -CHO è il gruppo formile.
Questa aldeide, una delle più leggere, è costituita da un liquido trasparente, infiammabile, meno denso dell'acqua. Inoltre, è solubile in acqua e miscibile con la maggior parte dei solventi organici; quindi può essere utilizzato per avere miscele organiche monofase.
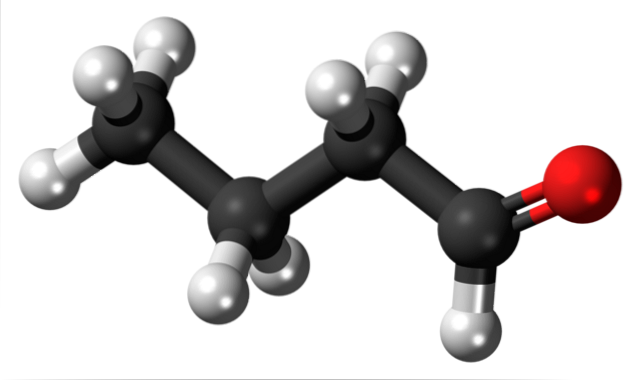
La presenza del gruppo carbonile (quello della sfera rossa, immagine in alto) conferisce polarità chimica alla molecola butanale, e quindi la capacità di sperimentare l'interazione dipolo-dipolo tra le sue molecole; sebbene non si formino legami idrogeno tra di loro.
Ciò si traduce in butanale con punti di ebollizione e di fusione più elevati del butano, ma inferiori a quelli presentati dall'alcol n-butilico..
Il butanale è usato come solvente ed è un intermedio per ottenere numerosi prodotti; come acceleratori di vulcanizzazione per gomme, resine, prodotti farmaceutici e prodotti agrochimici.
Il butanale è un composto tossico che per inalazione può provocare infiammazioni delle prime vie respiratorie, bronchi ed edema polmonare che possono avere conseguenze anche fatali.
Indice articolo
- 1 Struttura del butanale
- 1.1 Conformatori
- 2 Proprietà
- 2.1 Nomi chimici
- 2.2 Formula molecolare
- 2.3 Aspetto fisico
- 2.4 Odore
- 2.5 Punto di ebollizione
- 2.6 Punto di fusione
- 2.7 Punto di infiammabilità
- 2.8 Solubilità in acqua
- 2.9 Solubilità in solventi organici
- 2.10 Densità
- 2.11 Densità del vapore
- 2.12 Pressione di vapore
- 2.13 Autoaccensione
- 2.14 Viscosità
- 2.15 Calore di combustione
- 2.16 Calore di vaporizzazione
- 2.17 Tensione superficiale
- 2.18 Soglia di odore
- 2.19 Indice di rifrazione
- 2.20 Momento di dipolo
- 2.21 Lunghezze d'onda (λ) di massimo assorbimento in acqua
- 2.22 Polimerizzazione
- 2.23 Reattività
- 2.24 Condensa aldolica
- 3 Sintesi
- 4 Usi
- 4.1 Industriale
- 4.2 Altri
- 5 Rischi
- 6 Riferimenti
Struttura butanale
È stato appena detto che il gruppo formile, -CHO, conferisce polarità alla molecola butanale o butirraldeide a causa della maggiore elettronegatività dell'atomo di ossigeno. Di conseguenza, le sue molecole possono interagire tra loro attraverso forze dipolo-dipolo..
Nell'immagine in alto si mostra, con un modello di sfere e barre, che la molecola butanale ha una struttura lineare. Il carbonio del gruppo -CHO ha ibridazione spDue, mentre i rimanenti carboni sp ibridano3.
Non solo, ma è anche flessibile e le sue maglie possono ruotare sui propri assi; e così vengono generate diverse conformazioni o conformeri (stesso composto, ma con i loro collegamenti ruotati).
Conformatori
L'immagine seguente spiega meglio questo punto:
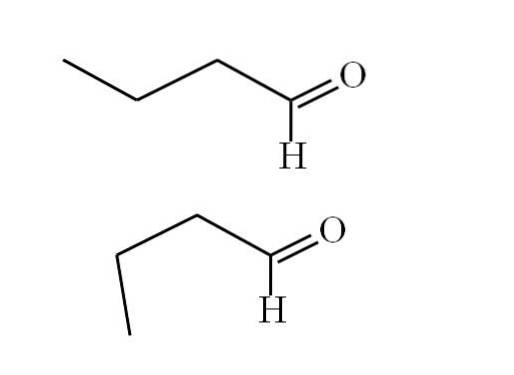
Il primo conformero (quello superiore) corrisponde alla molecola nella prima immagine: il gruppo metile a sinistra, -CH3, e il gruppo -CHO, sono in posizioni anti parallele tra loro; uno è rivolto rispettivamente verso l'alto e l'altro verso il basso.
Nel frattempo, il secondo conformero (quello inferiore) corrisponde alla molecola con -CH3 e il -CHO in posizioni eclissate; cioè, entrambi puntano nella stessa direzione.
Entrambi i conformeri sono rapidamente intercambiabili, e quindi la molecola butanale è costantemente in rotazione e vibrazione; e aggiunto il fatto che ha un dipolo permanente, ciò consente alle sue interazioni di essere abbastanza forti da bollire a 74,8 ° C..
Proprietà
Nomi chimici
-Butanal
-Butyraldehyde
-1-Butanal
-Butyral
-N-butirraldeide.
Formula molecolare
C4H8O o CH3CHDueCHDueCHO.
Aspetto fisico
È un liquido limpido e trasparente.
Odore
Odore caratteristico, pungente, aldeidico.
Punto di ebollizione
Da 167ºF a 760 mmHg (74,8 ° C).
Punto di fusione
-146 ºF (-96,86 ºC).
punto di accensione
-Tazza chiusa 8ºF (-22ºC).
Solubilità dell'acqua
7 g / 100 mL a 25 ºC.
Solubilità in solventi organici
Miscibile con etanolo, etere, acetato di etile, acetone, toluene e molti altri solventi organici.
Densità
0,803 g / cm3 a 68ºF.
Densità del vapore
2,5 (in relazione all'aria prelevata pari a 1).
Pressione del vapore
111 mmHg a 25 ºC.
Autoaccensione
446ºF. 425ºF (21,8ºC).
Viscosità
0,45 c Rumore a 20 ° C.
Calore di combustione
2479,34 kJ / mol a 25 ºC.
Calore di vaporizzazione
33,68 kJ / mol a 25 ºC.
Tensione superficiale
29,9 dyne / cm a 24 ºC.
Soglia di odore
0,009 ppm.
Indice di rifrazione
1,3843 a 20 ºC.
Momento di dipolo
2.72 D.
Lunghezze d'onda (λ) di massimo assorbimento in acqua
225 nm e 282 nm (luce ultravioletta).
Polimerizzazione
Il butanale può polimerizzare a contatto con alcali o acidi, essendo la polimerizzazione pericolosa.
Reattività
Quando esposto all'aria si ossida, formando acido butirrico. A una temperatura di 230 ° C, il butanale si accende spontaneamente con l'aria.
Condensazione aldolica
Due molecole di butanale possono reagire tra loro, in presenza di KOH e ad una temperatura di 6-8 ° C, per formare il composto 2-etil-3-idrossiesanolo. Questo tipo di composto è chiamato aldolo, poiché ha nella sua struttura un gruppo aldeidico e un gruppo alcolico.
Sintesi
Il butanale può essere prodotto dalla deidrogenazione catalitica dell'alcool n-butilico; l'idrogenazione catalitica della crotonaldeide; e l'idroformilazione del propilene.
Applicazioni
Industriale
-Il butanale è un solvente industriale, ma è anche un intermedio nella sintesi di altri solventi; per esempio 2-etilesanolo, n-butanolo e trimetilpropano.
-Viene anche utilizzato come intermedio nella produzione di resine sintetiche, compreso il polivinil butirrale; acceleratori di vulcanizzazione della gomma; fabbricazione di prodotti farmaceutici; prodotti per la protezione delle colture; pesticidi; antiossidanti; ausili per l'abbronzatura.
-Il butanale è utilizzato come materia prima per la produzione di aromi sintetici. Inoltre, è usato come agente aromatizzante alimentare.
Altri
-Nell'uomo, il butanale è utilizzato come biomarcatore indicativo del danno ossidativo subito da lipidi, proteine e acidi nucleici.
-Veniva utilizzato sperimentalmente, insieme alla formalina e alla glutardeide, per cercare di ridurre l'ammorbidimento sperimentato dagli zoccoli dei bovini, dovuto all'esposizione ad acqua, urina e feci dei bovini stessi. I risultati sperimentali sono stati positivi.
Rischi
Il butanale è distruttivo per le mucose del tratto respiratorio superiore, nonché per i tessuti della pelle e degli occhi..
A contatto con la pelle provoca arrossamenti e ustioni. Negli occhi si verificano le stesse lesioni, accompagnate da dolore e danni al tessuto oculare.
L'inalazione di butanale può avere gravi conseguenze, poiché può causare infiammazioni ed edemi alla laringe e ai bronchi; mentre nei polmoni produce polmonite chimica ed edema polmonare.
I segni di sovraesposizione includono: sensazione di bruciore nel tratto respiratorio superiore, tosse, respiro sibilante, cioè respiro sibilante durante la respirazione; laringite, mancanza di respiro, mal di testa, nausea e anche vomito.
L'inalazione può essere fatale a causa dello spasmo delle vie respiratorie.
L'ingestione di butanale provoca una sensazione di "bruciore" nel tratto digerente: cavo orale, faringe, esofago e stomaco.
Riferimenti
- Morrison, R. T. e Boyd, R. N. (1987). Chimica organica. (5ta Edizione.). Editoriale Addison-Wesley Iberoamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- PubChem. (2019). Butanal. Estratto da: pubchem.ncbi.nim.nih.guv
- Wikipedia. (2019). Butanal. Estratto da: es.wikipedia.org
- Libro chimico. (2017). Butanal. Estratto da: chemicalbook.com
- Basf. (Maggio 2017). N-butirraldeide. [PDF]. Estratto da: solvents.basf.com


Nessun utente ha ancora commentato questo articolo.