
Storia, proprietà, struttura, usi del boro
Il boro È un elemento non metallico che fa capo al gruppo 13 della tavola periodica ed è rappresentato dal simbolo chimico B. Il suo numero atomico è 5, ed è l'unico elemento non metallico nel suo gruppo; sebbene alcuni chimici lo considerino un metalloide.
Si presenta come una polvere bruno nerastra e si trova in una proporzione di 10 ppm rispetto alla crosta terrestre. Quindi non è uno degli elementi più abbondanti.

Si trova come parte di diversi minerali come il borace o il borato di sodio, essendo questo il minerale di boro più comune. Ci sono anche kurnite, un'altra forma di borato di sodio; colemanite o borato di calcio; e ulexite, sodio e borato di calcio.
I borati vengono estratti negli Stati Uniti, Tibet, Cina e Cile con una produzione mondiale di circa due milioni di tonnellate all'anno.
Questo elemento ha tredici isotopi, l'essere più abbondante undiciB, che costituisce l'80,1% del boro in peso, e 10B, che costituisce il restante 19,9%.
Il boro è un oligoelemento essenziale per le piante, interviene nella sintesi di alcune proteine vegetali vitali e contribuisce all'assorbimento dell'acqua. Nei mammiferi sembra essere necessario per la salute delle ossa.
Sebbene il boro sia stato scoperto nel 1808 dal chimico inglese Sir Humphry Davy e dai chimici francesi Jacques Thérnard e Joseph Gay-Lussac, dall'inizio della nostra era in Cina il borace è stato utilizzato nella produzione di ceramiche smaltate.
Il boro ei suoi composti hanno molti usi e applicazioni, che vanno dal suo utilizzo nella conservazione degli alimenti, in particolare margarina e pesce, al suo utilizzo nel trattamento dei tumori cancerosi del cervello, della vescica, della prostata e di altri organi.
Il boro è scarsamente solubile in acqua, ma i suoi composti lo sono. Questo potrebbe essere un meccanismo di concentrazione del boro, nonché una fonte di avvelenamento con l'elemento..
Indice articolo
- 1 Storia
- 1.1 Contesto
- 1.2 Scoperta degli elementi
- 1.3 Identificazione e isolamento
- 2 Proprietà
- 2.1 Descrizione fisica
- 2.2 Massa molare
- 2.3 Punto di fusione
- 2.4 Punto di ebollizione
- 2.5 Densità
- 2.6 Calore di fusione
- 2.7 Calore di vaporizzazione
- 2.8 Capacità termica molare
- 2.9 Energia di ionizzazione
- 2.10 Elettronegatività
- 2.11 Raggio atomico
- 2.12 volume atomico
- 2.13 Conduttività termica
- 2.14 Resistività elettrica
- 2.15 Durezza
- 2.16 Reattività
- 3 Struttura e configurazione elettronica del boro
- 3.1 Collegamenti e unità strutturali in boro
- 3.2 boro α-romboedrico
- 3,3 boro β-romboedrico
- 3.4 Salgemma di boro-γ
- 3.5 Cubico e amorfo
- 3.6 Borofeni
- 3.7 Configurazione elettronica
- 4 Ottenimento
- 5 Usi
- 5.1 Nell'industria
- 5.2 In medicina
- 5.3 Azione biologica
- 6 Rischi e precauzioni
- 7 Riferimenti
Storia
sfondo
Fin dai tempi antichi, l'uomo ha utilizzato i composti del boro in varie attività. Il borace, un minerale noto come tincal, fu usato in Cina nel 300 d.C. nella produzione di ceramiche a smalto.
L'alchimista persiano Rhazes (865-925) fece la prima menzione dei composti del boro. Rhazes ha classificato i minerali in sei classi, una delle quali era i boracios che includeva il boro.
Agricola, intorno al 1600, riportò l'uso del borace come flusso nella metallurgia. Nel 1777 fu riconosciuta la presenza di acido borico in un torrente termale nei pressi di Firenze.
Scoperta degli elementi
Humphry Davy, mediante elettrolisi di una soluzione di borace, ha osservato l'accumulo di un precipitato nero su uno degli elettrodi. Ha anche riscaldato l'ossido di boro (BDueO3) con potassio, producendo una polvere marrone nerastra che era la forma nota di boro.
Gay-Lussac e Thénard hanno ridotto l'acido borico ad alte temperature in presenza di ferro per produrre boro. Hanno anche mostrato il processo inverso, cioè dove l'acido borico è un prodotto dell'ossidazione del boro.
Identificazione e isolamento
Jöns Jakob Berzelius (1827) riuscì a identificare il boro come un nuovo elemento. Nel 1892, il chimico francese Henri Moissan riuscì a produrre boro con il 98% di purezza. Tuttavia, si sottolinea che il boro è stato prodotto in forma pura dal chimico americano Ezekiel Weintraub, nell'anno 1909.
Proprietà
Descrizione fisica
Polvere cristallina marrone-nera solida o amorfa.
Massa molare
10,821 g / mol.
Punto di fusione
2076 ºC.
Punto di ebollizione
3927 ºC.
Densità
-Liquido: 2,08 g / cm3.
-Cristallino e amorfo a 20 ºC: 2,34 g / cm3.
Calore di fusione
50,2 kJ / mol.
Calore di vaporizzazione
508 kJ / mol.
Capacità termica molare
11,087 J / (mol K)
Energia ionizzata
-Primo livello: 800,6 kJ / mol.
-Secondo livello: 2.427 kJ / mol.
-Terzo livello: 3.659,7 kJ / mol.
Elettronegatività
2.04 della scala Pauling.
Radio atomica
90 pm (empirico).
Volume atomico
4,16 cm3/ mol.
Conduttività termica
27,4 W / m.K
Resistività elettrica
~ 106 Ω.m (a 20 ° C).
Il boro alle alte temperature è un buon conduttore elettrico, ma a temperatura ambiente diventa quasi un isolante.
Durezza
~ 9.5 sulla scala di Mohs.
Reattività
Il boro non è influenzato dall'acido cloridrico al punto di ebollizione. Tuttavia, viene convertito dall'acido nitrico caldo in acido borico (H.3BO3). Il boro si comporta chimicamente come un non metallo.
Reagisce con tutti gli alogeni dando trialogenuri altamente reattivi. Questi hanno la formula generale BX3, dove X rappresenta l'alogeno.
Si combina con vari elementi per dare origine ai boruri. Alcuni di loro sono tra le sostanze più dure; per esempio, nitruro di boro (BN). Il boro si combina con l'ossigeno per formare il triossido di boro.
Struttura e configurazione elettronica del boro
Collegamenti e unità strutturali in boro
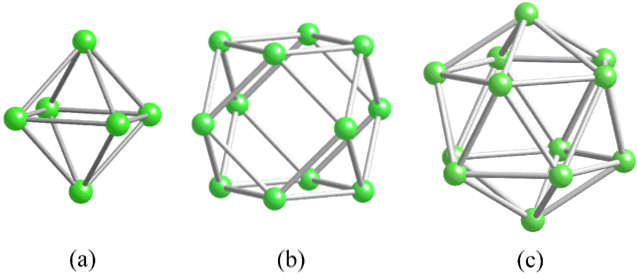
Prima di affrontare le strutture del boro (cristallino o amorfo) è essenziale tenere presente come i suoi atomi possono essere collegati. Il legame B-B è essenzialmente covalente; Non solo, ma poiché gli atomi di boro presentano naturalmente una carenza elettronica, cercheranno di fornirla nei loro legami in un modo o nell'altro..
Nel boro si osserva un particolare tipo di legame covalente: quello con tre centri e due elettroni, 3c2e. Qui tre atomi di boro condividono due elettroni e definiscono un triangolo, una delle tante facce che si trovano nei loro poliedri strutturali (immagine in alto).
Da sinistra a destra abbiamo: ottaedro (a, B6), cubottaedro (b, B12) e l'isocashedron (c, B12 anche). Tutte queste unità condividono una caratteristica: sono povere di elettroni. Pertanto, tendono a collegarsi in modo covalente tra loro; e il risultato è una festa di collegamenti sorprendenti.
In ogni triangolo di questi poliedri è presente il legame 3c2e. Altrimenti non si potrebbe spiegare come il boro, in grado di formare solo tre legami covalenti secondo la teoria dei legami di Valencia, possa avere fino a cinque legami in queste unità poliedriche..
Le strutture di boro consistono quindi in una disposizione e ripetizione di queste unità che finiscono per definire un cristallo (o un solido amorfo).
Boro α-romboedrico
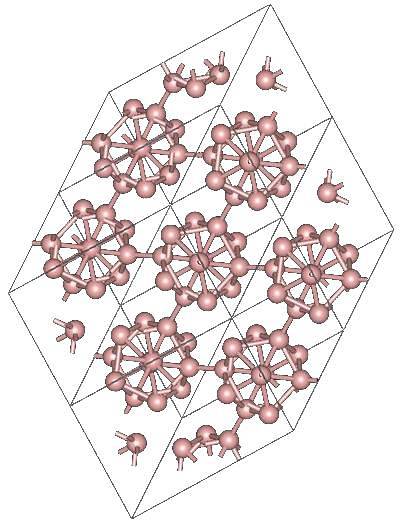
Potrebbero esserci altre unità di boro poliedriche, nonché una composta da soli due atomi, BDue; una “linea” di boro che deve essere legata ad altri atomi a causa della sua elevata carenza elettronica.
L'icosaedro è di gran lunga l'unità preferita del boro; quello che più ti si addice. Nell'immagine sopra, ad esempio, puoi vedere come queste unità B.12 si intrecciano per definire il cristallo romboedrico di Boro-α.
Se si volesse isolare uno di questi icosaedri sarebbe un compito complicato, poiché la sua carenza elettronica li costringe a definire un cristallo in cui ognuno fornisce gli elettroni di cui gli altri vicini hanno bisogno..
Boro Β-romboedrico
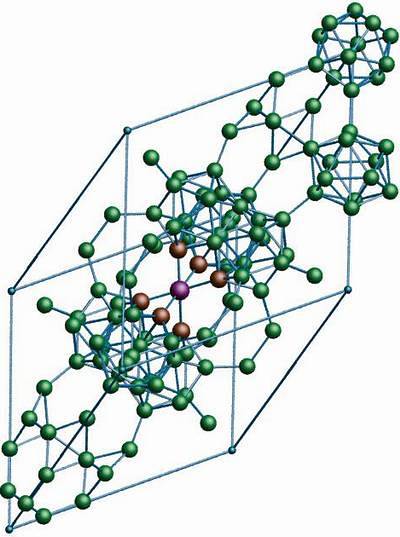
L'allotropo boro β-romboedrico, come già indica il nome, ha cristalli romboedrici come il boro-α; tuttavia differisce nelle sue unità strutturali. Sembra una nave aliena fatta di atomi di boro.
Se guardi attentamente, le unità icosaedriche possono essere viste in modo discreto e fuso (al centro). Esistono anche unità B.10 e atomi di boro solitari che fungono da ponte per le unità menzionate. Di tutti, questo è l'allotropo del boro più stabile.
Sale grosso di boro-γ
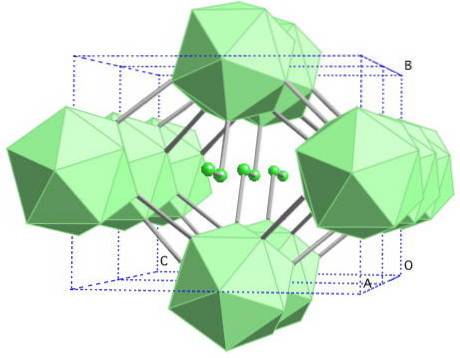
In questo allotropo del boro le unità B sono coordinateDue e B12. Il BDue è così elettronicamente carente che in realtà rimuove gli elettroni da B12 e c'è, quindi, un carattere ionico all'interno di questo solido. Cioè, non solo sono legati in modo covalente, ma esiste un'attrazione elettrostatica di tipo [BDue-] [B12+].
Il boro-γ si cristallizza in una struttura di salgemma, la stessa del NaCl. Si ottiene sottoponendo altri allotropi del boro ad alte pressioni (20 GPa) e temperature (1800 ° C), per poi rimanere stabili in condizioni normali. La sua stabilità compete effettivamente con quella del boro β-romboedrico.
Cubico e amorfo
Altri allotropi di boro sono costituiti da aggregati di atomi di B come se fossero uniti da un legame metallico, o come se fossero cristalli ionici; cioè, è un boro cubico.
Inoltre, e non meno importante, è il boro amorfo, la cui disposizione delle unità B.12 è casuale e disordinato. Si presenta come una polvere vetrosa solida o fine di colore marrone opaco e scuro.
Borofeni
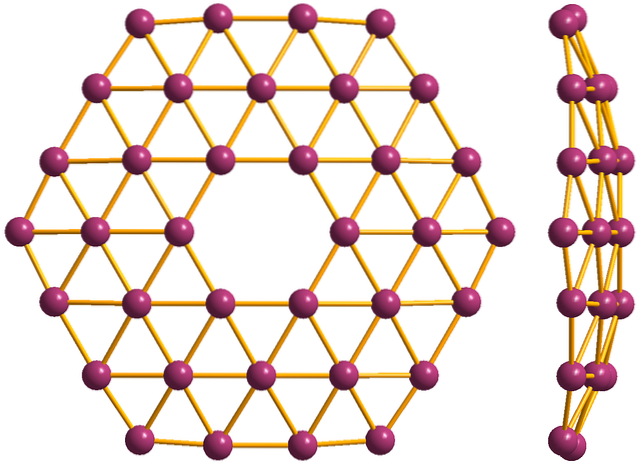
E infine c'è il più nuovo e bizzarro allotropo del boro: i borofeni (immagine in alto). È costituito da un monostrato di atomi di boro; estremamente sottile e analogo al grafene. Da notare che conserva i famosi triangoli, caratteristici della carenza elettronica subita dai suoi atomi.
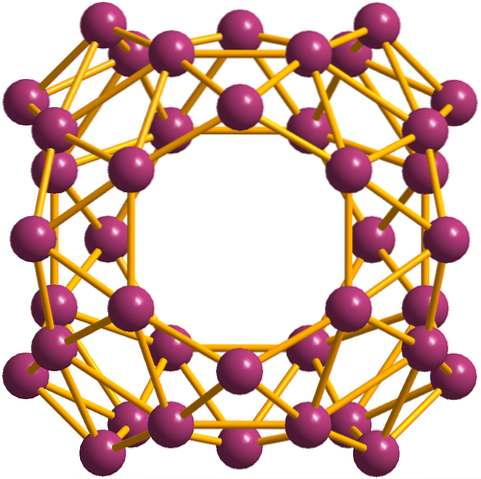
Oltre ai borofeni, di cui il B36 è il più semplice e il più piccolo, ci sono anche i grappoli di boro. La borosfera (immagine sotto) è costituita da una gabbia sferica simile a una palla di quaranta atomi di boro, B40; ma invece di avere bordi lisci, sono bruschi e frastagliati:
Configurazione elettronica
La configurazione elettronica del boro è:
[He] 2sDue 2 P1
Ha quindi tre elettroni di valenza. Ci vogliono altri cinque per completare il suo ottetto di valenza, e riesce a malapena a formare tre legami covalenti; avrebbe bisogno di un quarto collegamento dativo per completare il suo ottetto. Il boro può perdere i suoi tre elettroni per acquisire uno stato di ossidazione di +3.
Ottenere
Il boro viene isolato riducendo l'acido borico con magnesio o alluminio; metodo simile a quello utilizzato da Gay-Lussac e Thénard. Ha la difficoltà di contaminare il boro con i boruri di questi metalli.
Un campione di elevata purezza può essere ottenuto mediante riduzione in fase gassosa di boro tricloruro, o tribromuro, con idrogeno su filamenti di tantalio riscaldati elettricamente..
Un boro ad elevata purezza viene preparato mediante decomposizione ad alta temperatura del diborano, seguita da purificazione mediante fusione a zone o processi Czocharalski..
Applicazioni
Nell'industria
Il boro elementare è stato utilizzato nell'indurimento dell'acciaio. In una lega con ferro contenente dallo 0,001 allo 0,005% di boro. Viene anche utilizzato nell'industria non ferrosa, solitamente come disossidante.
Inoltre, il boro viene utilizzato come degasatore in rame ad alta conduttanza e leghe a base di rame. Nell'industria dei semiconduttori, piccole quantità di boro vengono aggiunte con cura come agente drogante per silicio e germanio..
Ossido di boro (BDueO3) viene miscelato con silice per creare un vetro resistente al calore (vetro borosilicato), utilizzato negli utensili da cucina e in alcune apparecchiature di laboratorio.
Carburo di boro (B4C) è una sostanza estremamente dura che viene utilizzata come agente abrasivo e rinforzante nei materiali compositi. Boruro di alluminio (AlB12) viene utilizzato come sostituto della polvere di diamante per la molatura e la lucidatura.
Il boro è utilizzato nelle leghe, ad esempio i magneti delle terre rare, legando ferro e neodimio. I magneti formati sono utilizzati nella produzione di microfoni, interruttori magnetici, cuffie e acceleratori di particelle.
In medicina
La capacità dell'isotopo boro-10 (10B) per intrappolare i neutroni, l'emissione di radiazioni di tipo α è stata utilizzata per il trattamento dei tumori cerebrali in una tecnica nota come Boron Neutron Capture Therapy (BNCT).
Il 10Il composto B si accumula nel tumore canceroso. Successivamente, l'area del tumore viene irradiata con neutroni. Questi interagiscono con 10B, che causa l'emissione di particelle α. Queste particelle hanno un elevato effetto biologico relativo e, a causa delle loro grandi dimensioni, hanno una portata ridotta..
Pertanto, l'azione distruttiva delle particelle α rimane confinata nelle cellule tumorali, effettuando la loro distruzione. BNCT è anche utilizzato nel trattamento dei tumori cancerosi del collo, del fegato, della vescica e della prostata..
Azione biologica
Una piccola quantità di boro, sotto forma di acido borico o borato, è necessaria per la crescita di molte piante. Una carenza di boro si manifesta nella crescita deforme delle piante; il "cuore marrone" delle verdure; e il "marciume secco" delle barbabietole da zucchero.
Il boro può essere necessario in piccole quantità per mantenere la salute delle ossa. Ci sono studi che indicano che la mancanza di boro sarebbe coinvolta nella generazione di artrite. Interverrebbe anche nelle funzioni cerebrali come la memoria e la coordinazione occhio-mano.
Alcuni esperti sottolineano che nella dieta quotidiana dovrebbero essere inclusi da 1,5 a 3 mg di boro.
Rischi e cautela
Boro, ossido di boro, acido borico e borati sono considerati non tossici. La DL50 per gli animali è di 6 g di boro / kg di peso corporeo, mentre le sostanze con una LD50 superiore a 2 g / kg di peso corporeo sono considerate non tossiche..
D'altra parte, il consumo di più di 0,5 mg / giorno di boro per 50 giorni provoca lievi problemi digestivi, indicativi di tossicità. Alcuni rapporti indicano che un eccesso nell'assunzione di boro può influenzare il funzionamento di stomaco, fegato, reni e cervello.
Inoltre, sono stati segnalati effetti irritanti a breve termine sul rinofaringe, sul tratto respiratorio superiore e sugli occhi a causa dell'esposizione al boro..
Le segnalazioni di tossicità da boro sono scarse e in molti casi la tossicità si manifesta a dosi molto elevate, superiori a quelle a cui è esposta la popolazione generale..
La raccomandazione è di monitorare il contenuto di boro degli alimenti, in particolare frutta e verdura. Le agenzie sanitarie governative devono garantire che la concentrazione di boro dell'acqua non superi i limiti consentiti..
I lavoratori esposti alla polvere contenente boro devono indossare maschere di protezione delle vie respiratorie, guanti e stivali speciali..
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Allotropi del boro. Estratto da: en.wikipedia.org
- Prof. Robert J. Lancashire. (2014). Lezione 5b. Struttura degli elementi (non metalli, B, C). Il Dipartimento di Chimica, Università delle Indie Occidentali, Mona Campus, Kingston 7, Giamaica. Estratto da: chem.uwimona.edu.jm
- Manisha Lalloo. (28 gennaio 2009). Scoperta struttura di boro ultra puro. Mondo della chimica. Estratto da: chemistryworld.com
- Bell Terence. (16 dicembre 2018). Un profilo del boro metallico. Estratto da: thebalance.com
- The Editors of Encyclopaedia Britannica. (2019). Boro. Estratto da: britannica.com
- Agenzia per le sostanze tossiche e il registro delle malattie. (2010). ToxFAQs ™ sul boro. [PDF]. Recupero da: atsdr.cdc.gov
- Helmenstine, Anne Marie, Ph.D. (6 febbraio 2019). Proprietà chimiche e fisiche del boro. Estratto da: thoughtco.com



Nessun utente ha ancora commentato questo articolo.