
Benzil benzil idrogeni, carbocationi, radicali benzilici
Il benzile o benzile è un gruppo sostituente comune in chimica organica la cui formula è C6H5CHDue- o Bn-. Strutturalmente consiste semplicemente nell'unione di un gruppo metilenico, CHDue, con un gruppo fenile, C6H5; cioè un carbonio sp3 legato direttamente a un anello benzenico.
Pertanto, il gruppo benzile può essere visto come un anello aromatico attaccato a una piccola catena. In alcuni testi, si preferisce l'uso dell'abbreviazione Bn al posto di C6H5CHDue-, essere facilmente riconoscibile in qualsiasi composto; specialmente se collegato a un atomo di ossigeno o azoto, O-Bn o NBnDue, rispettivamente.

Questo gruppo si trova anche implicitamente in una serie di composti ampiamente noti. Ad esempio, all'acido benzoico, C6H5COOH, potrebbe essere considerato come un benzile il cui carbonio sp3 ha subito un'ampia ossidazione; o benzaldeide, C6H5CHO, da una parziale ossidazione; e alcool benzilico, C6H5CHDueOh, ancora meno arrugginito.
Un altro esempio piuttosto ovvio di questo gruppo può essere trovato nel toluene, C6H5CH3, che può subire un certo numero di reazioni a causa della insolita stabilità derivante dai radicali benzilici o dai carbocationi. Tuttavia, il gruppo benzile serve a proteggere i gruppi OH o NH.Due di reazioni che modificano indesiderabilmente il prodotto da sintetizzare.
Indice articolo
- 1 Esempi di composti con gruppo benzile
- 2 idrogeni benzilici
- 3 Carbocationi e radicali benzilici
- 3.1 Risonanza nel gruppo benzile
- 3.2 Altri radicali
- 4 Reazioni
- 5 Riferimenti
Esempi di composti con gruppo benzile
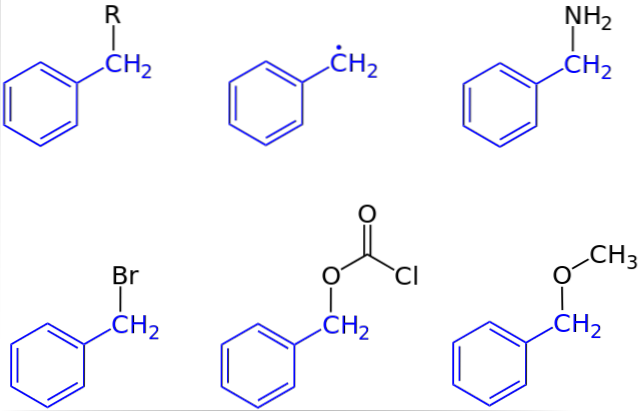
Nella prima immagine è stata mostrata la rappresentazione generale di un composto con un gruppo benzilico: C6H5CHDue-R, dove R può essere qualsiasi altro frammento molecolare o atomo. Così, variando R si può ottenere un numero elevato di esempi; alcuni semplici, altri solo per una regione specifica di una struttura o di un insieme più ampio.
L'alcol benzilico, ad esempio, è derivato dalla sostituzione di OH per R: C6H5CHDue-OH. Se invece di OH è il gruppo NHDue, quindi nasce il composto della benzilammina: C6H5CHDue-NHDue.
Se Br è l'atomo che sostituisce R, il composto risultante è benzil bromuro: C6H5CHDue-Br; R per CODueCl dà origine a un estere, benzilclorocarbonato (o carbobenzoxil cloruro); e OCH3 dà origine a benzil metil etere, C6H5CHDue-OCH3.
Anche (anche se non del tutto correttamente), R può essere assunto da un elettrone solitario: il radicale benzile, C6H5CHDue·, Prodotto della liberazione del radicale R ·. Un altro esempio, sebbene non incluso nell'immagine, è il fenilacetonitrile o il benzil cianuro, C6H5CHDue-CN.
Ci sono composti in cui il gruppo benzile rappresenta a malapena una regione specifica. In questo caso, l'abbreviazione Bn viene spesso utilizzata per semplificare la struttura e le sue illustrazioni..
Idrogeni benzilici
I suddetti composti hanno in comune non solo l'anello aromatico o fenilico, ma anche gli idrogeni benzilici; questi sono quelli che appartengono alla sp carbon3.
Tali idrogeni possono essere rappresentati come: Bn-CH3, Bn-CHDueR o Bn-CHRDue. Il composto Bn-CR3 manca di idrogeno benzilico, e quindi la sua reattività è inferiore a quella degli altri.
Questi idrogeni sono diversi da quelli che di solito sono attaccati a un carbonio sp3.
Ad esempio, considera il metano, CH4, che può anche essere scritto come CH3-H. Per la rottura del legame CH3-H in una ripartizione eterolitica (formazione di radicali), deve essere fornita una certa quantità di energia (104kJ / mol).
Tuttavia, l'energia per lo stesso legame C si rompe6H5CHDue-H è inferiore rispetto al metano (85 kJ / mol). Poiché questa energia è inferiore, implica che il radicale C6H5CHDueÈ più stabile di CH3·. Lo stesso accade in misura maggiore o minore con altri idrogeni benzilici.
Di conseguenza, gli idrogeni benzilici sono più reattivi nel generare radicali o carbocationi più stabili rispetto a quelli causati da altri idrogeni. Perché? La risposta alla domanda viene fornita nella sezione successiva.
Carbocationi e radicali benzilici
Il radicale C era già stato considerato6H5CHDue·, In mancanza del carbocatione benzilico: C6H5CHDue+. Nel primo c'è un elettrone solitario spaiato e nel secondo una deficienza elettronica. Le due specie sono molto reattive e rappresentano composti transitori da cui provengono i prodotti finali della reazione..
Carbon sp3, dopo aver perso uno o due elettroni per formare il radicale o il carbocatione, rispettivamente, può adottare l'ibridazione spDue (piano trigonale), in modo tale che vi sia la minima repulsione possibile tra i suoi gruppi elettronici. Ma se capita di essere spDue, Come i carboni anulari aromatici, può avvenire la coniugazione? La risposta è si.
Risonanza nel gruppo benzilico
Questa coniugazione o risonanza è il fattore chiave per spiegare la stabilità di queste specie derivate dal benzile o dal benzile. L'immagine seguente illustra un tale fenomeno:
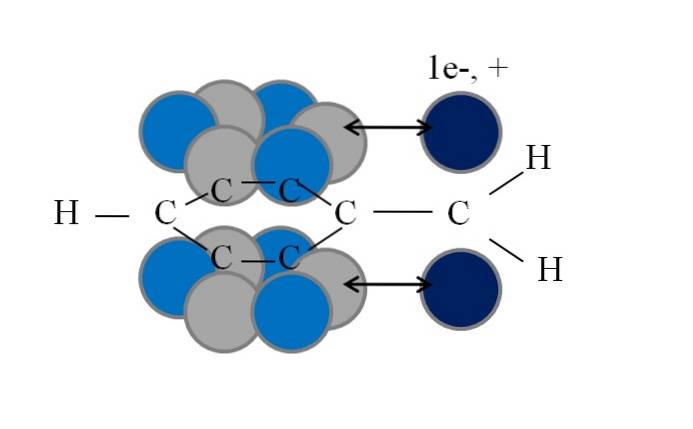
Si noti che dove si trovava uno degli idrogeni benzilici, è rimasto un orbitale p con un elettrone spaiato (radicale, 1e-) o void (carbocation, +). Come si può vedere, questo orbitale p è parallela al sistema aromatico (i cerchi grigio e azzurro), con la doppia freccia che indica l'inizio della coniugazione.
Pertanto, sia l'elettrone spaiato che la carica positiva possono essere trasferiti o dispersi attraverso l'anello aromatico, poiché il parallelismo dei loro orbitali lo favorisce geometricamente. Tuttavia, questi non si trovano in nessun orbitale p anello aromatico; solo in quelli appartenenti ai carboni in posizione orto e para rispetto a CHDue.
Ecco perché i cerchi azzurri si stagliano sopra quelli grigi: in essi si concentra rispettivamente la densità negativa o positiva del radicale o del carbocatione..
Altri radicali
Va detto che questa coniugazione o risonanza non può verificarsi negli atomi di carbonio sp3 più distante dall'anello aromatico.
Ad esempio, il radicale C6H5CHDueCHDueÈ molto più instabile perché l'elettrone spaiato non può coniugarsi con l'anello quando interviene il gruppo CHDue in mezzo e con ibridazione sp3. Lo stesso vale per C6H5CHDueCHDue+.
Reazioni
In sintesi: gli idrogeni benzilici tendono a reagire, generando un radicale o un carbocatione, che a sua volta finisce per causare il prodotto finale della reazione. Pertanto, reagiscono tramite un meccanismo SN.1.
Un esempio è la bromurazione del toluene sotto la radiazione ultravioletta:
C6H5CH3 + 1 / 2BrDue => C6H5CHDueBr
C6H5CHDueBr + 1 / 2BrDue => C6H5CHBrDue
C6H5CHBrDue + 1 / 2BrDue => C6H5CBr3
Infatti in questa reazione si producono radicali Br..
D'altra parte, il gruppo benzile stesso reagisce per proteggere i gruppi OH o NH.Due in una semplice reazione di sostituzione. Pertanto, un alcol ROH può essere 'benzilato' usando benzil bromuro e altri reagenti (KOH o NaH):
ROH + BnBr => ROBn + HBr
ROBn è un etere benzilico, al quale può essere restituito il suo gruppo OH iniziale se sottoposto a un mezzo riduttivo. Questo etere dovrebbe rimanere invariato mentre vengono eseguite altre reazioni sul composto..
Riferimenti
- Morrison, R.T. e Boyd, R. N. (1987). Chimica organica. (5a edizione). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Chimica organica. (6a edizione). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Wikipedia. (2019). Gruppo benzilico. Estratto da: en.wikipedia.org
- Dr. Donald L. Robertson. (5 dicembre 2010). Fenile o benzile? Estratto da: home.miracosta.edu
- Gamini Gunawardena. (2015, 12 ottobre). Carbocation benzilico. Chemistry LibreTexts. Recupero da: chem.libretexts.org


Nessun utente ha ancora commentato questo articolo.