
Storia, struttura, proprietà, derivati, usi del benzene
Il benzene È un composto organico costituito da uno degli idrocarburi aromatici più semplici di tutti. La sua formula chimica è C6H6, di cui è noto che il rapporto tra carbonio e idrogeno è pari a 1; cioè, per ogni carbonio c'è un idrogeno legato ad esso.
Sebbene il suo aspetto fisico sia quello di un liquido incolore, si trova naturalmente nel petrolio e nei prodotti petroliferi. Il suo odore è molto caratteristico, in quanto ricorda una miscela di colla, bitume e benzina; d'altra parte, è un liquido volatile e infiammabile.

L'immagine sopra mostra un contenitore o una bottiglia con benzene, presumibilmente di purezza non analitica. Se scoperti, i vapori di benzene si diffonderebbero immediatamente in tutto il laboratorio. Per questo motivo questo liquido, comunemente usato come semplice solvente, viene movimentato all'interno di una cappa aspirante..
Essendo la sua formula C6H6, i chimici del XIX secolo proposero numerose possibili strutture che corrispondessero a detto rapporto C / H uguale a 1. Non solo questo, ma la molecola del benzene doveva avere legami speciali in modo tale da poter spiegare la sua insolita stabilità contro le reazioni di addizione; tipico per alcheni e polieni.
Fu così che i loro legami rappresentarono un enigma per i chimici di quel tempo; fino a quando la proprietà non ha chiamato aromaticità. Prima di essere considerato un esaciclotriene (con tre legami C = C), il benzene è molto di più, ed è un altro dei tanti esempi di sinergia in chimica.
Nella chimica organica, il benzene è un simbolo classico, la base strutturale per più composti poliaromatici. Derivati infiniti sono ottenuti dal suo esagono tramite sostituzione elettrofila aromatica; un anello dai cui bordi si intreccia la struttura che definisce nuovi composti.
Infatti, i suoi derivati sono dovuti ai vasti usi industriali per i quali hanno bisogno del benzene come materia prima. Dalla preparazione di colle e fibre tessili, a plastiche, gomme, pigmenti, farmaci ed esplosivi. D'altra parte, il benzene si trova naturalmente nei vulcani, negli incendi boschivi, nella benzina e nel fumo di sigaretta..
Indice articolo
- 1 Storia
- 1.1 Scoperta e nomi
- 1.2 Produzione industriale
- 1.3 Strutture storiche
- 2 Struttura del benzene
- 2.1 Risonanza
- 2.2 Cristalli
- 3 Proprietà
- 3.1 Massa molecolare
- 3.2 Aspetto fisico
- 3.3 Punto di ebollizione
- 3.4 Punto di fusione
- 3.5 Punto di infiammabilità
- 3.6 Temperatura di autoaccensione
- 3.7 Densità
- 3.8 Solubilità
- 3.9 Densità del vapore
- 3.10 Pressione di vapore
- 3.11 Calore di combustione
- 3.12 Calore di vaporizzazione
- 3.13 tensione superficiale
- 3.14 Indice di rifrazione
- 4 Derivati
- 5 Usi
- 6 Nomenclatura
- 7 Tossicità
- 8 Riferimenti
Storia
Scoperta e nomi
La sua scoperta risale al 1825, solitamente attribuita a Michael Faraday, quando raccolse e fece esperimenti con un prodotto petrolifero residuo del gas utilizzato per l'illuminazione. Questo liquido conteneva un rapporto C / H vicino a 1, motivo per cui lo chiamava "idrogeno carburato".
Il chimico Auguste Laurent ha chiamato lo strano idrocarburo "feno", derivato dalla parola greca "phaínein'che significa brillante (perché è stato ottenuto dopo la combustione del gas). Tuttavia, questo nome non è stato accettato dalla comunità scientifica e ha prevalso solo come 'fenile', per riferirsi al radicale derivato dal benzene.
Dalla gomma al benzoino il chimico Eilhard Mitscherlich, nove anni dopo, riuscì a produrre lo stesso composto; Pertanto, c'era un'altra fonte per lo stesso idrocarburo, che ha battezzato come "benzina". Tuttavia, non hanno considerato nemmeno il nome appropriato, supponendo che fosse un alcaloide, come il chinino..
Pertanto, hanno sostituito il nome "benzine" con "benzol". Tuttavia, ancora una volta c'erano contraddizioni e discrepanze dovute al termine "benzolo" che confondeva l'idrocarburo con un alcol. Fu allora che nacque il nome "benzene", usato per la prima volta in Francia e in Inghilterra..
Produzione industriale
Né il gas di illuminazione né la gomma di benzoino erano fonti appropriate per la generazione di benzene su larga scala. Charles Mansfield, in collaborazione con August Wilhelm von Hofmann, riuscì nel 1845 a isolare il benzene (vent'anni dopo la sua scoperta) dal catrame di carbone, un prodotto secondario della produzione di coke..
Inizia così la produzione industriale di benzene dal catrame di carbone. La disponibilità di benzene in quantità massicce ha facilitato lo studio delle sue proprietà chimiche e ha permesso di metterlo in relazione con altri composti con reattività simili. Lo stesso August Wilhelm von Hofmann ha coniato la parola "aromatico" per il benzene e composti correlati.
Strutture storiche
Il sogno di August Kekulé
A Friedrich August Kekulé viene attribuita la struttura esagonale e ciclica del benzene intorno all'anno 1865, derivante da uno strano sogno con Uroboros, il serpente che si morde la coda tracciando un cerchio. Pertanto, credeva che il benzene potesse essere considerato come un anello esagonale e altri chimici proposero possibili strutture, che sono mostrate di seguito:

Alcune delle strutture superiori potrebbero spiegare la stabilità del benzene.
Libro, anelli e prisma
Si noti che la terza struttura non è nemmeno un anello ma un prisma triangolare, proposto da Albert Ladenburg nel 1869; alla sua sinistra, uno a forma di libro aperto, proposto da Sir James Dewar nel 1867; e alla sua destra, uno con tutti gli idrogeni diretti verso il centro dell'anello, proposto da Henry Edward Armstrong nel 1887.
Particolare è anche la prima struttura, proposta da Adolf Karl Ludwig Claus nel 1867, poiché i collegamenti C-C sono incrociati. E l'ultimo era l'anello "serpentino" di Kekulé, sognato nel 1865.
Qual è stato il "vincitore"? La quinta struttura (da sinistra a destra), proposta nel 1899 da Johannes Thiele.
In questo studio è stato considerato per la prima volta l'ibrido di risonanza, che ha unito le due strutture di Kekulé (ruotare il primo anello a destra per osservarlo) e ha spiegato straordinariamente la delocalizzazione degli elettroni e, con essa, la stabilità fino ad allora insolita di il benzene.
Struttura del benzene
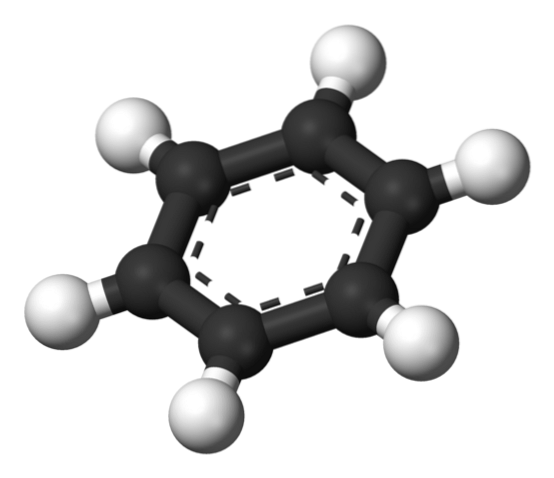
Sopra è la struttura proposta da Thiele utilizzando un modello di sfere e barre..
La molecola di benzene è piatta, con gli atomi di idrogeno che puntano verso l'esterno dai lati dell'anello. Tutti gli atomi di carbonio hanno ibridazione spDue, con un orbitale p disponibile per stabilire il sistema aromatico in cui si delocalizzano sei elettroni.
Questi carboni spDue sono più elettronegativi degli idrogeni, e quindi i primi ritirano la densità elettronica al secondo (C.sp2δ--Hδ+). Di conseguenza, il centro dell'anello ha una maggiore concentrazione di elettroni rispetto ai suoi lati..
Più precisamente, il sistema aromatico può essere rappresentato come una nuvola elettronica o un tampone espanso su entrambi i lati dell'anello esagonale; e al centro, ai lati o ai bordi, una deficienza elettronica costituita da idrogeni con carica parziale positiva.
Grazie a questa distribuzione di cariche elettriche, le molecole di benzene possono interagire tra loro tramite forze dipolo-dipolo; Atomi di H.δ+ sono attratti dal centro olfattivo di un anello vicino (questo sarà rappresentato di seguito).
Inoltre, i centri aromatici possono essere sovrapposti uno sull'altro per favorire l'induzione dei dipoli istantanei..
Risonanza

Le due strutture Kekulé sono mostrate nella parte superiore dell'immagine e sotto di esse, l'ibrido di risonanza. Poiché le due strutture si ripetono più e più volte contemporaneamente, l'ibrido è rappresentato da un cerchio disegnato al centro (simile a quello di una "ciambella esagonale").
Il cerchio ibrido è importante perché indica il carattere aromatico del benzene (e quello di molti altri composti). Inoltre, sottolinea che i collegamenti non sono lunghi come C-C, né sono corti come C = C; ma la lunghezza della stessa è tra i due estremi. Pertanto, il benzene non è considerato un poliene.
Quanto sopra è stato dimostrato misurando le lunghezze dei legami C-C (139 pm) del benzene, che sono un po 'più allungate dei legami C-H (109 pm).
Cristalli
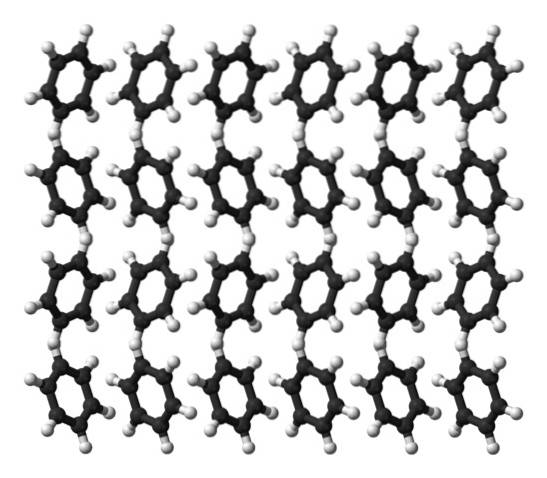
Il benzene è un liquido a temperatura ambiente. Le sue forze intermolecolari significano che, nonostante non abbia un momento di dipolo così pronunciato, può tenere insieme le sue molecole in un liquido che bolle a 80 ° C. Quando la temperatura scende sotto i 5ºC, il benzene inizia a gelare: si ottengono così i suoi cristalli corrispondenti..
Gli anelli di benzene possono adottare modelli strutturali definiti nel loro solido. I loro dipoli li fanno "inclinare" verso sinistra o verso destra, formando file che possono essere riprodotte da una cellula unitaria ortorombica. Pertanto, i cristalli di benzene sono ortorombici.
Si noti nell'immagine in alto che l'inclinazione degli anelli favorisce le interazioni tra l'Hδ+ e centri aromatici, menzionati nelle sottosezioni precedenti.
Proprietà
Massa molecolare
78,114 g / mol.
Aspetto fisico
Liquido incolore con un odore simile alla benzina.
Punto di ebollizione
80ºC.
Punto di fusione
5,5ºC.
punto di accensione
-11ºC (vaso chiuso).
Temperatura di autoaccensione
497,78ºC.
Densità
0,8765 g / mL a 20ºC.
Solubilità
Un litro di acqua bollente può a malapena sciogliere 3,94 g di benzene. Il suo carattere non polare lo rende praticamente immiscibile con l'acqua. Tuttavia, è miscibile con altri solventi, come etanolo, eteri, acetone, oli, cloroformio, tetracloruro di carbonio, ecc..
Densità del vapore
2.8 rispetto all'aria (cioè quasi tre volte più denso).
Pressione del vapore
94,8 mm Hg a 25 ° C.
Calore di combustione
-3267,6 kJ / mol (per benzene liquido).
Calore di vaporizzazione
33,83 kJ / mol.
Tensione superficiale
28,22 mN / ma 25 ° C.
Indice di rifrazione
1.5011 a 20ºC.
Derivati
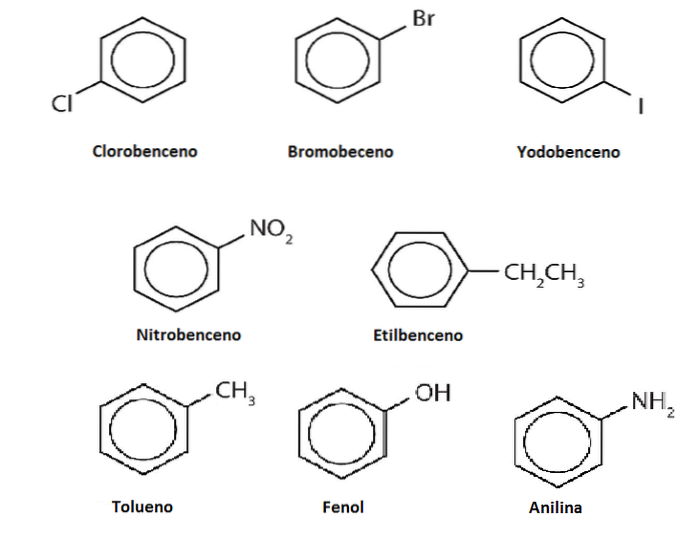
Gli idrogeni del benzene possono essere sostituiti da altri gruppi o atomi. Possono esserci una o più sostituzioni, aumentando il grado di sostituzione fino a quando nessuno dei sei idrogeni originali rimane.
Ad esempio, si supponga che il benzene sia Ph-H, dove H è uno dei suoi sei idrogeni. Ricordando che il centro dell'anello ha una maggiore densità di elettroni, attrae gli elettrofili, che attaccano l'anello per sostituire H in una reazione chiamata sostituzione elettrofila aromatica (SEAr).
Se questa H viene sostituita da un OH, avremo Ph-OH, fenolo; essere sostituito da un CH3, Ph-CH3, toluene; se è NHDue, Ph-NHDue, anilina; o se è il CHDueCH3, Ph-CHDueCH3, etilbenzene.
I derivati possono essere uguali o più tossici del benzene, o al contrario, possono diventare così complessi da avere un effetto farmacologico desiderabile..
Applicazioni
È un buon solvente per un'ampia varietà di composti, presente ad esempio in pitture, vernici, adesivi e rivestimenti.
Può anche sciogliere oli, grassi o cere, motivo per cui è stato utilizzato come solvente per l'estrazione di essenze. Questa proprietà venne utilizzata da Ludwig Roselius nel 1903 per decaffeinizzare il caffè, operazione non più in uso a causa della tossicità del benzene. Allo stesso modo, è stato utilizzato in passato per sgrassare i metalli.
In uno dei suoi usi classici, non agisce come un solvente ma come un additivo: aumentando il numero di ottani della benzina, sostituendo a questo scopo il piombo..
I derivati del benzene possono avere usi differenti; alcuni servono come pesticidi, lubrificanti, detergenti, plastica, esplosivi, profumi, coloranti, colle, droghe, ecc. Se si osserva un anello benzenico nella sua struttura, è molto probabile che la sua sintesi sia iniziata dal benzene.
Tra i suoi derivati più importanti ci sono: cumene, xilene, anilina, fenolo (per la sintesi delle resine fenoliche), acido benzoico (conservante), cicloesano (per la sintesi del nylon), nitrobenzene, resorcinolo ed etilbenzene.
Nomenclatura
La nomenclatura dei derivati del benzene varia a seconda del grado di sostituzione, di cosa sono i gruppi sostituenti e delle loro posizioni relative. Pertanto, il benzene può subire sostituzioni mono, di, tri, tetra, ecc
Quando i due gruppi sono attaccati ad atomi di carbonio adiacenti, viene utilizzata la designazione "orto"; se c'è un carbonio nel mezzo che li separa, "meta"; e se i carboni sono in posizioni opposte, "para".
Le immagini seguenti mostrano esempi di derivati del benzene con i rispettivi nomi disciplinati dalla IUPAC. Sono anche accompagnati da nomi comuni o tradizionali.
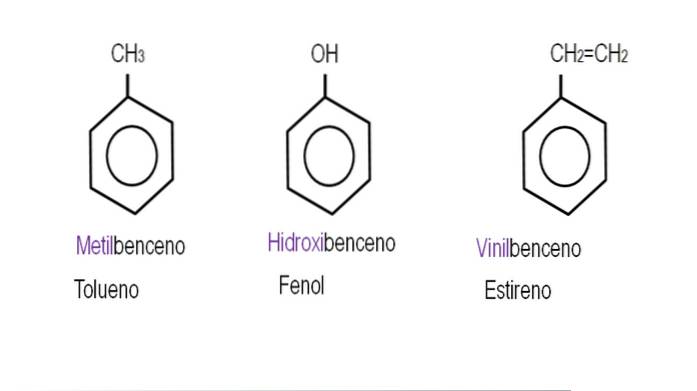
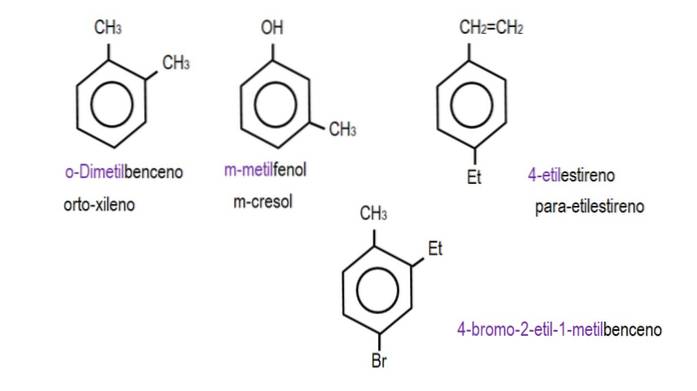
Si noti che nel benzene trisostituito gli indicatori orto, para e meta non sono più utili..
Tossicità
Il benzene è un composto che deve essere maneggiato con cura. Dato il suo odore particolare, gli effetti negativi immediati possono essere soffocamento, vertigini, mal di testa, tremori, sonnolenza, nausea e persino morte (con elevata esposizione). Se ingerito, oltre a quanto sopra, può provocare forti dolori allo stomaco e convulsioni..
Inoltre, gli effetti a lungo termine sotto costante esposizione a questo liquido sono cancerogeni; aumenta le possibilità che l'individuo soffra di qualche tipo di cancro, in particolare il cancro del sangue: la leucemia.
Nel sangue può diminuire la concentrazione dei globuli rossi, provocando anemia, e colpire anche il midollo osseo e il fegato, dove viene assimilato dall'organismo per generare derivati del benzene ancora più tossici; per esempio, idrossichinone. Si accumula anche nei reni, nel cuore, nei polmoni e nel cervello..
Riferimenti
- Morrison, R.T. e Boyd, R. N. (1987). Chimica organica. (5a edizione). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Chimica organica. (6a edizione). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Benzene. Database PubChem. CID = 241, recuperato da: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Benzene. Estratto da: en.wikipedia.org
- Garcia Nissa. (2019). Cos'è il benzene? - Usi, struttura e formula. Studia. Estratto da: study.com
- Centri per il controllo e la prevenzione delle malattie. (4 aprile 2018). Fatti sul benzene. Estratto da: emergency.cdc.gov
- Organizzazione mondiale della Sanità. (2010). Esposizione al benzene: una delle principali preoccupazioni per la salute pubblica. [PDF]. Estratto da: who.int
- Fernández Germán. (s.f.). Problemi di nomenclatura del benzene. Chimica organica. Estratto da: quimicaorganica.org



Nessun utente ha ancora commentato questo articolo.