
Struttura, proprietà, preparazione, usi del blu di bromotimolo
Il blu di bromotimolo È un colorante sensibile al pH del suo ambiente ed è stato utilizzato come indicatore in molte reazioni di laboratorio. Un indicatore è un colorante organico il cui colore dipende dalla concentrazione dello ione H.3O+ o il pH del mezzo. Dal colore visualizzato l'indicatore può indicare l'acidità o la basicità della soluzione.
Il blu di bromotimolo ha una scala di indicazione attiva tra pH 6,0 e 7,6. Ad un pH del mezzo inferiore a 6,5 presenta una colorazione gialla. Quando il pH del mezzo varia tra 6,5 e 7,6, acquisisce un colore verde. A pH superiore a 7,6 il suo colore è blu.

Questa caratteristica rende questo indicatore molto utile, poiché può essere utilizzato in una scala di pH prossima alla neutralità; proprio dove avvengono i processi fisiologici.
La ionizzazione del blu di bromotimolo in soluzione acquosa può essere delineata come segue:
HIn (colore giallo) + HDueO <=> Nel- (colore blu) + H.3O+
Quando l'indicatore è protonato (HIn) acquista un colore giallo; mentre se l'indicatore deprotonato (In-) diventa blu.
Indice articolo
- 1 Struttura chimica
- 1.1 Cambiamenti di pH
- 2 Proprietà
- 2.1 Nome chimico
- 2.2 Formula molecolare
- 2.3 Peso molecolare
- 2.4 Aspetto fisico
- 2.5 Caratteristiche chimiche
- 2.6 Costante di dissociazione ionica (Ka)
- 2.7 Campo di indicazione attivo
- 2.8 Densità
- 2.9 Punto di fusione
- 2.10 Punto di ebollizione
- 2.11 Solubilità
- 2.12 Stabilità
- 2.13 Assorbimento della luce
- 3 Usi e applicazioni
- 3.1 Negli studi metabolici
- 3.2 In ostetricia
- 3.3 Altri usi
- 4 Preparazione
- 5 Riferimenti
Struttura chimica
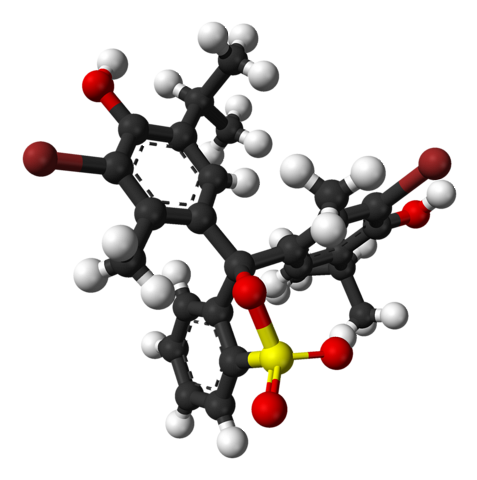
L'immagine in alto rappresenta la struttura del blu di bromotimolo con un modello a barra e sfera a un pH inferiore a 7,1. Le barre marroni corrispondono agli atomi di bromo, due in totale.
Ciascuno dei tre anelli aromatici compone, insieme ai gruppi metilici, CH3, e tertbutile, il gruppo timolo; e avendo collegato un Br, da lì deriva il motivo per cui è chiamato 'bromotimolo'.
In basso è mostrato il gruppo solfonato, R-SO3-, con sfere rosse e una gialla. Questo gruppo può essere collegato tramite un atomo di O al carbonio centrale che unisce i tre anelli aromatici.
Cambiamenti di pH
Sebbene questa struttura molecolare non cambi radicalmente con il pH acido o basico, i suoi stati elettronici sono alterati, riflessi dai cambiamenti nel colore delle soluzioni.
Al di sotto del pH 7, l'indicatore è di colore giallo e adotta la struttura dell'immagine; ma se il pH diventa basico, i gruppi -OH si deprotonato e si può formare un doppio legame C = O.
Di conseguenza, il sistema coniugato della molecola (quello di tutti i suoi doppi legami risonanti) cambia abbastanza che gli elettroni non assorbono più gli stessi fotoni e la soluzione vira dal giallo al bluastro..
Se invece il pH è ben al di sotto di 7, il colore dell'indicatore cambia da giallo a rosso. Qui il cambiamento nel sistema coniugato è dovuto alla protonazione dei gruppi -OH in -OHDue+. -
In ambienti sia acidi che basici, la molecola perde stabilità, assorbendo fotoni di minore energia per consentire le transizioni elettroniche responsabili dei colori percepiti dagli spettatori..
E il colore verde dell'immagine principale? Quando il pH si avvicina a 7,1, una piccola porzione di molecole perde protoni, emanando un colore blu che, mescolato con il giallo, dà il colore verde..
Proprietà
Nome chimico
Blu di bromotimolo o 3,3'-dibromotimolsulfonaftaleina.
Formula molecolare
C27H28BrDueO5S.
Peso molecolare
624,384 g / mol.
Aspetto fisico
Polvere solida con un colore che va dal rosa al viola.
Caratteristica chimica
Agisce come un acido debole in soluzione. Quando è protonato in mezzo acido acquista un colore giallo, a pH neutro è verde, e quando è deprotonato a pH alcalino è blu.
Costante di dissociazione ionica (Ka)
7,9 x 10-8.
Campo di indicazione attivo
pH da 6,0 a 7,6. Ciò è dovuto alla presenza di atomi di bromo che agiscono per estrarre elettroni e due gruppi donatori di elettroni moderati (sostituenti alchilici).
Densità
1,25 g / cm3.
Punto di fusione
202 ºC (396 º F).
Punto di ebollizione
184,9 ºC.
Solubilità
È scarsamente solubile in acqua e olio. Allo stesso modo, è scarsamente solubile in solventi non polari come benzene, toluene e xilene e praticamente insolubile in etere di petrolio. È solubile in soluzioni acquose alcaline e in alcool.
Stabilità
È stabile a temperatura ambiente e incompatibile con forti agenti ossidanti.
Assorbimento della luce
La forma protonata ha il suo massimo assorbimento ad una lunghezza d'onda (λ) di 427 nm, trasmettendo così luce gialla in soluzioni acide e la forma deprotonata ha un massimo assorbimento ad una lunghezza d'onda (λ) di 602 nm, trasmettendo una luce blu. A pH alcalino.
Usi e applicazioni
Negli studi metabolici
Il blu di bromotimolo è utilizzato in molti processi in cui l'anidride carbonica (CODue), con la conseguente generazione di acido carbonico (H.DueCO3), che acidifica il mezzo; evidenziato da un cambiamento nella colorazione del blu di bromotimolo.
Se una persona sta facendo esercizio fisico ed è collegata a un tubo che, a sua volta, è collegato a un contenitore con una soluzione di blu di bromotimolo, si osserverà il seguente fenomeno: come conseguenza dell'aumento dell'attività fisica e del metabolismo, si verificherà un aumento della produzione di CODue.
Il CODue reagirà con l'acqua, producendo acido carbonico, H.DueCO3, che successivamente si dissocia rilasciando lo ione H.+ e acidificando il mezzo. Di conseguenza, il blu di bromotimolo acquisisce un colore giallo, evidenziando l'acidità del mezzo..
In ostetricia
Il blu di bromotimolo è utilizzato in ostetricia per mostrare la rottura precoce delle membrane. Il liquido amniotico normalmente ha un pH maggiore di 7,7, quindi il blu di bromotimolo diventerà blu quando entra in contatto con il fluido che fuoriesce dall'amnios..
Il pH vaginale è solitamente acido, quindi il blu di bromotimolo ha una tinta gialla. Il cambiamento del suo colore in blu evidenzia la presenza di liquido amniotico nella regione vaginale.
Altri usi
Il blu di bromotimolo trova applicazione anche nelle seguenti apparecchiature e funzioni:
-Sensori ottici
-Sistemi di rilevamento combustione gas
-Nella produzione di vernici, giocattoli, prodotti per la pulizia, detergenti e tessuti
-Sensori di freschezza degli alimenti
-Come manico per riso fresco e raffermo
-Nella rilevazione di microrganismi.
Viene anche utilizzato nell'analisi della crescita batterica, farmaci psicoattivi e materiali dentali..
Preparazione
100 mg di blu di bromotimolo vengono sciolti in 100 mL di alcool diluito e filtrati se necessario. Si prepara inoltre come segue: 50 mg di blu di bromotimolo vengono sciolti in una miscela di 4 mL di idrossido di sodio 0,02 N e 20 mL di alcool, fino a 100 mL con acqua.
Riferimenti
- Wikipedia. (2018). Blu di bromotimolo. Estratto da: en.wikipedia.org
- Foist L. (2018). Blu di bromotimolo: definizione, usi e formula. Studia. Estratto da: study.com
- The Science Company. (2018). Indicatore di pH blu di bromotimolo, 1 oz. Estratto da: sciencecompany.com
- Determinazione spettrofotometrica del pK dell'indicatore blu di bromotimolo. Recupero da: fch.upol.cz
- PubChem. (2018). Blu di bromotimolo. Estratto da: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2015). Blu di bromotimolo. ChemSpider. Estratto da: chemspider.com
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.

Nessun utente ha ancora commentato questo articolo.