
Proprietà, struttura, usi ed esempi degli alchini
Il alchini Sono idrocarburi o composti organici che hanno un triplo legame tra due atomi di carbonio nelle loro strutture. Questo triplo legame (≡) è considerato un gruppo funzionale in quanto rappresenta un sito attivo della molecola, e quindi è responsabile della loro reattività.
Sebbene gli alchini non siano molto diversi dagli alcani o dagli alcheni, mostrano una maggiore acidità e polarità a causa della natura dei loro legami. Il termine preciso per descrivere questa leggera differenza è ciò che è noto come insaturazione.

Gli alcani sono idrocarburi saturi, mentre gli alchini sono i più insaturi rispetto alla struttura originaria. Cosa significa questo? Che un alcano H3C-CH3 (etano) può essere deidrogenato a H.DueC = CHDue (etene) e successivamente a HC≡CH (ethyne, o meglio noto come acetilene).
Nota come quando si formano legami aggiuntivi tra i carboni, il numero di idrogeni legati ad essi diminuisce. Il carbonio, per le sue caratteristiche elettroniche, cerca di formare quattro legami semplici, quindi maggiore è l'insaturazione, maggiore è la tendenza a reagire (ad eccezione dei composti aromatici).
D'altra parte, il triplo legame è molto più forte del doppio legame (=) o del singolo legame (-), ma ad un alto costo energetico. Quindi, la maggior parte degli idrocarburi (alcani e alcheni) può formare tripli legami a temperature elevate..
Come conseguenza delle alte energie di questi, e quando si rompono, rilasciano molto calore. Un esempio di questo fenomeno si osserva quando l'acetilene viene bruciato con l'ossigeno e il calore intenso della fiamma viene utilizzato per saldare o fondere i metalli (immagine in alto).
L'acetilene è l'alchino più semplice e più piccolo di tutti. Altri idrocarburi possono essere espressi dalla sua formula chimica sostituendo l'H per i gruppi alchilici (RC≡CR '). Lo stesso accade nel mondo della sintesi organica attraverso un gran numero di reazioni.
Questo alchino è prodotto dalla reazione dell'ossido di calcio da calcare e coke, una materia prima che fornisce i carboni necessari in un forno elettrico:
CaO + 3C => CaCDue + CO
Il CaCDue È il carburo di calcio, un composto inorganico che alla fine reagisce con l'acqua per formare acetilene:
CaCDue + 2HDueO => Ca (OH)Due + HC≡CH
Indice articolo
- 1 Proprietà fisiche e chimiche degli alchini
- 1.1 Polarità
- 1.2 Acidità
- 2 Reattività
- 2.1 Idrogenazione
- 2.2 Aggiunta di alogenuri di idrogeno
- 2.3 Idratazione
- 2.4 Aggiunta di alogeni
- 2.5 Alchilazione dell'acetilene
- 3 Struttura chimica
- 3.1 Distanza dei collegamenti e alchini terminali
- 4 Nomenclatura
- 5 Usi
- 5.1 Acetilene o etina
- 5.2 Alchini naturali
- 6 Esempi di alchini
- 6.1 Acido taririco
- 6.2 Istrionicotossina
- 6.3 Cicutoxin
- 6.4 Capillini
- 6.5 Pargyline
- 7 Riferimenti
Proprietà fisiche e chimiche degli alchini
Polarità
Il triplo legame distingue gli alchini dagli alcani e dagli alcheni. I tre tipi di idrocarburi sono apolari, insolubili in acqua e acidi molto deboli. Tuttavia, l'elettronegatività dei carboni a doppio e triplo legame è maggiore di quella dei carboni singoli..
Di conseguenza, i carboni adiacenti al triplo legame producono densità di carica negativa per effetto induttivo. Per questo motivo, dove sono i legami C≡C o C = C, ci sarà una densità elettronica maggiore rispetto al resto dello scheletro di carbonio. Di conseguenza, c'è un piccolo momento di dipolo in cui le molecole interagiscono per forze dipolo-dipolo..
Queste interazioni sono molto deboli se i loro momenti di dipolo vengono confrontati con quelli della molecola d'acqua o di qualsiasi alcool. Ciò si riflette nelle loro proprietà fisiche: gli alchini hanno generalmente punti di fusione e di ebollizione più elevati rispetto ai loro idrocarburi meno insaturi..
Allo stesso modo, a causa della loro bassa polarità, sono meno insolubili in acqua, ma sono solubili in solventi organici non polari come il benzene..
Acidità
Inoltre, questa elettronegatività causa l'idrogeno HC≡CR è più acido di qualsiasi altro presente in altri idrocarburi. Pertanto, gli alchini sono specie più acide degli alcheni e molto più acidi degli alcani. Tuttavia, la sua acidità è ancora trascurabile rispetto a quella degli acidi carbossilici..
Poiché gli alchini sono acidi molto deboli, reagiscono solo con basi molto forti, come l'ammide di sodio:
HC≡CR + NaNHDue => HC≡CNa + NH3
Da questa reazione si ottiene una soluzione di acetiluro di sodio, materia prima per la sintesi di altri alchini..
Reattività
La reattività degli alchini è spiegata dall'aggiunta di piccole molecole al loro triplo legame, diminuendo la loro insaturazione. Queste potrebbero essere molecole di idrogeno, alogenuri di idrogeno, acqua o alogeni..
Idrogenazione
La piccola molecola di H.Due è molto sfuggente e veloce, quindi per aumentare le possibilità che vengano aggiunti al triplo legame degli alchini, è necessario utilizzare catalizzatori.
Si tratta solitamente di metalli (Pd, Pt, Rh o Ni) finemente suddivisi per aumentare la superficie; e quindi, il contatto tra idrogeno e alchino:
RC≡CR '+ 2HDue => RCHDueCHDueR '
Il risultato è che l'idrogeno è "ancorato" ai carboni rompendo un legame, e così via fino a produrre l'alcano corrispondente, RCHDueCHDueR '. Questo non solo satura l'idrocarburo iniziale, ma ne modifica anche la struttura molecolare..
Aggiunta di alogenuri di idrogeno
Qui viene aggiunta la molecola inorganica HX, dove X può essere uno qualsiasi degli alogeni (F, Cl, Br o I):
RC≡CR '+ HX => RCH = CXR'
Idratazione
L'idratazione degli alchini avviene quando aggiungono una molecola d'acqua per formare un'aldeide o un chetone:
RC≡CR '+ HDueO => RCHDueCOR '
Se R 'è una H, è un'aldeide; se è un alchile, allora è un chetone. Nella reazione, un composto noto come enol (RCH = C (OH) R ') si forma come intermedio..
Questo subisce una conversione dalla forma enolica (C-OH) alla forma chetonica (C = O) in un equilibrio chiamato tautomerizzazione.
Aggiunta di alogeni
E rispetto alle aggiunte, le molecole biatomiche degli alogeni (XDue= FDue, ClDue, BrDue ho sentitoDue):
RC≡CR '+ 2XDue => RCXDue-CXDueR '
Alchilazione dell'acetilene
Altri alchini possono essere preparati dalla soluzione di acetiluro di sodio utilizzando un alogenuro alchilico:
HC≡CNa + RX => HC≡CR + NaX
Ad esempio, se fosse metil ioduro, l'alchino risultante sarebbe:
HC≡CNa + CH3I => HC≡CCH3 + NaX
HC≡CCH3 è il suggerimento, noto anche come metileacetilene.
Struttura chimica
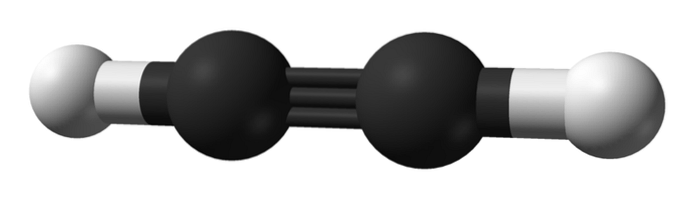
Qual è la struttura degli alchini? Nell'immagine in alto è mostrata una molecola di acetilene. Da esso si può osservare chiaramente la geometria lineare del legame C enlaceC.
Pertanto, dove c'è un triplo legame, la struttura della molecola dovrebbe essere lineare. Questa è un'altra delle notevoli differenze tra loro e il resto degli idrocarburi.
Gli alcani sono solitamente rappresentati come zigzag, perché hanno ibridazione sp3 e i loro collegamenti sono distanti 109º. In realtà sono una catena di tetraedri legati in modo covalente. Mentre gli alcheni sono piatti dall'ibridazione spDue dei suoi atomi di carbonio, formando più specificamente un piano trigonale con legami separati da 120º.
Negli alchini l'ibridazione orbitale è sp, cioè hanno il 50% di carattere se il 50% di carattere p. Esistono due orbitali sp ibridi che si legano agli atomi di H nell'acetilene o ai gruppi alchilici negli alchini..
La distanza tra le due H o R è di 180º, oltre al fatto che solo in questo modo gli orbitali p puri dei carboni possono formare il triplo legame. Per questo motivo il legame -C≡C- è lineare. Osservando la struttura di qualsiasi molecola, il -C≡C- risalta in quelle regioni in cui lo scheletro è molto lineare.
Distanza dei collegamenti e degli alchini terminali
I carboni nel triplo legame sono più vicini tra loro che nel doppio o singolo legame. In altre parole, C≡C è più corto di C = C e C-C. Di conseguenza, il legame è più forte perché i due legami π aiutano a stabilizzare il singolo legame σ..
Se il triplo legame è alla fine di una catena, allora è un alchino terminale. Pertanto la formula di detto composto deve essere HC≡CR, dove H evidenzia la fine o l'inizio della catena.
Se invece è un triplo legame interno, la formula è RC≡CR ', dove R e R' sono il lato destro e sinistro della catena.
Nomenclatura
Come vengono denominati gli alchini secondo le regole dettate dalla IUPAC? Allo stesso modo in cui sono stati nominati alcani e alcheni. A tale scopo, il suffisso -ano o -eno viene modificato nel suffisso -ino.
Ad esempio: l'HC≡CCH3 è chiamato propino, poiché ha tre atomi di carbonio, come il propano (CH3CHDueCH3). L'HC≡CCHDueCH3 è 1-butino, che è un alchino terminale. Ma nel caso del CH3C≡CCH3 è 2-butino, e in questo il triplo legame non è terminale ma interno.
Il CH3C≡CCHDueCHDue(CH3)Due è 5-metil-2-esine. I carboni vengono contati dal lato più vicino al triplo legame.
Un altro tipo di alchini sono le cicloalcine. Per loro è sufficiente sostituire il suffisso -ano con -ino del corrispondente cicloalcano. Quindi il ciclopropano che ha un triplo legame è chiamato ciclopropino (che non esiste).
Quando sono presenti due tripli legami, il prefisso di- viene aggiunto al nome. Esempi sono HC≡C-C≡H, diacetilene o propadino; e ad HC≡C-C-C≡H, butadiino.
Applicazioni
Acetilene o etina
Il più piccolo degli alchini addensa il numero possibile di usi di questi idrocarburi. Da esso, attraverso alchilazioni, possono essere sintetizzati altri composti organici. Allo stesso modo, subisce reazioni ossidative per ottenere etanolo, acido acetico, acido acrilico, tra gli altri..
Un altro dei suoi usi consiste nel fornire la fonte di calore per eccitare gli elettroni degli atomi; più specificamente dei cationi metallici nelle determinazioni di assorbimento-emissione atomica, una tecnica spettroscopica ampiamente utilizzata.
Alchini naturali
Gli unici metodi esistenti per preparare gli alchini non sono solo sintetici o con applicazione di calore in assenza di ossigeno, ma anche biologici.
Questi usano enzimi chiamati acetilenasi, che può deidrogenare un doppio legame. Grazie a ciò si ottengono molte fonti naturali di alchini.
Di conseguenza, da queste fonti possono essere estratti veleni, antidoti, medicinali o qualsiasi altro composto che fornisce qualche beneficio; soprattutto quando si tratta di salute. Le alternative sono molte quando si modificano le loro strutture originali e le si ha come supporto per nuovi alchini..
Esempi di alchini
Finora sono stati citati numerosi esempi di alchini. Tuttavia, alcuni provengono da fonti molto specifiche o hanno strutture molecolari particolari: sono poliacetileni.
Ciò significa che può esserci più di un triplo legame che fa parte di una struttura molto grande e non solo una semplice catena di carbonio..
Acido taririco

L'acido taririco proviene da una pianta situata in Guatemala chiamata Picramnia tariri. Viene estratto specificatamente dall'olio dei suoi semi.
Nella sua struttura molecolare si può osservare un unico triplo legame che separa una coda apolare da una testa polare; quindi potrebbe essere considerata una molecola anfipatica.
Istrionicotossina
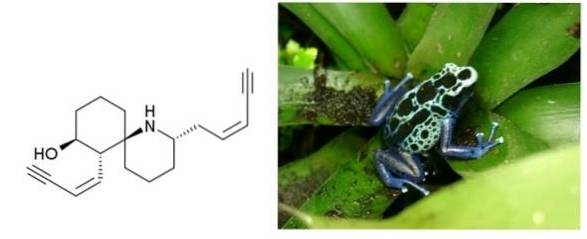
su en.wikipedia [dominio pubblico], da Wikimedia Commons
L'istrionicotossina è un veleno secreto dalla pelle delle rane che abitano la Colombia, il Brasile e altri paesi dell'America Latina. Ha due tripli legami coniugati a un doppio legame. Entrambi sono terminali e separati da un anello di sei atomi di carbonio e un'ammina ciclica..
Cicutossina
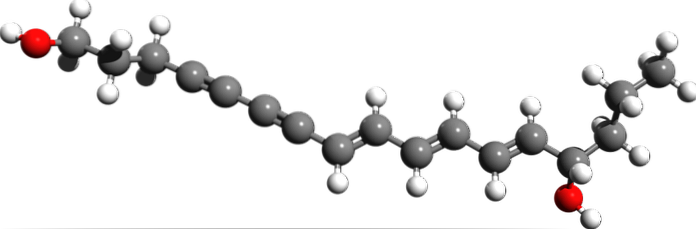
Dalla struttura molecolare della cicutossina, dove sono i tripli legami? Se i doppi legami sono piatti, come si vede a destra, ei singoli legami sono tetraedrici, come alle estremità, le triple sono lineari e sono sul pendio (\).
Questo composto è costituito da una neurotossina che si trova principalmente nella pianta acquatica della cicuta..
Capillina
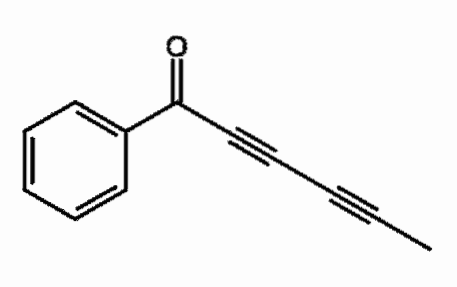
È un alchino presente nell'olio essenziale delle piante di artemisia che viene utilizzato come agente antifungino. Si possono osservare due tripli legami consecutivi, coniugati più correttamente.
Cosa significa? Quei tripli legami risuonano lungo l'intera catena del carbonio e coinvolgono il doppio legame C = O che si apre a C-O-.
Pargyline
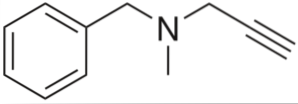
È un alchino con attività antipertensiva. Analizzando la sua struttura per parti, abbiamo: un gruppo benzile a sinistra, un'ammina terziaria al centro e un propinile a destra; cioè un gruppo propino terminale.
Riferimenti
- Francis A. Carey. Chimica organica. Acidi carbossilici. (sesta ed., pp. 368-397). Mc Graw Hill.
- Brennan, John. (10 marzo 2018). Esempi di alchini. Scienza. Tratto da: sciencing.com
- BYJU'S. (2018). Triplo legame in Alkynes. Tratto da: byjus.com
- Enciclopedia degli esempi (2017). Alkynes. Estratto da: examples.co
- Kevin A. Boudreaux. Alkynes. Tratto da: angelo.edu
- Robert C. Neuman, Jr. Alkenes e Alkynes. [PDF]. Tratto da: chem.ucr.edu


Nessun utente ha ancora commentato questo articolo.