
Struttura, proprietà, usi, produzione dell'acetato di potassio
Il acetato di potassio è un composto organico formato da uno ione K di potassio+ e uno ione acetato CH3COO-. La sua formula chimica è CH3COOK o KCH3COO, o anche CDueH3KODue. È un solido cristallino incolore o bianco, molto solubile in acqua..
Viene utilizzato per regolare l'acidità di alcuni alimenti trasformati industrialmente. Per la sua grande affinità con l'acqua, viene utilizzato nei laboratori o in determinati processi per assorbire l'acqua da altri composti, come ad esempio per disidratare l'alcol..

L'acetato di potassio partecipa ad alcune reazioni chimiche come acceleratore di queste e alla sintesi di composti organici. Consente inoltre di aumentare la formazione di anticorpi (sostanze naturali che combattono le infezioni) nei metodi industriali per produrli..
Le sue proprietà a temperature molto basse lo rendono un buon candidato per l'uso in miscele per lo scioglimento del ghiaccio su strade in cemento in climi molto freddi. Secondo le fonti consultate, viene utilizzato anche nelle attrezzature antincendio e nelle assemblee per osservare le cellule nei microscopi..
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Densità
- 3.5 Solubilità
- 3,6 pH
- 3.7 Altre proprietà
- 3.8 Comportamento durante il riscaldamento
- 4 Ottenimento
- 5 Usi
- 5.1 In varie applicazioni
- 5.2 Nell'industria dei polimeri
- 5.3 Nei laboratori di ricerca scientifica e medica
- 5.4 Nella produzione industriale di anticorpi
- 5.5 Nelle miscele antigelo
- 5.6 Come funziona come antigelo
- 6 Riferimenti
Struttura
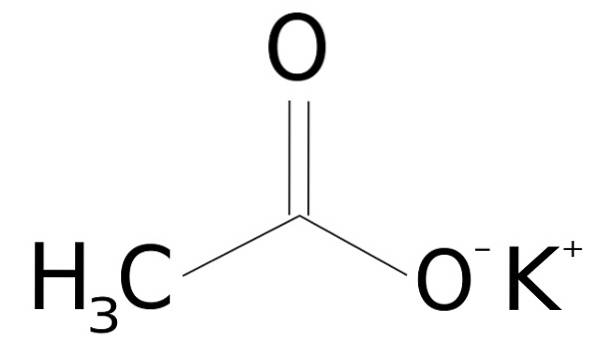
L'acetato di potassio è costituito da un catione K. di potassio+ e un anione acetato CH3COO-. Quest'ultima è la base coniugata dell'acido acetico CH3COOH. Lo ione acetato CH3COO- è costituito da un metile -CH3 attaccato a un carbossilato -COO-.
L'unione tra entrambi gli ioni è elettrostatica o ionica, cioè l'unione tra uno ione positivo e uno negativo.
Nomenclatura
- Acetato di potassio
- Etanoato di potassio
- Sale di potassio dell'acido acetico
- AcOK
- KOAc
Proprietà
Stato fisico
Solido cristallino incolore o bianco.
Peso molecolare
98,14 g / mol
Punto di fusione
292 ºC
Densità
1,6 g / cm3
Solubilità
Molto solubile in acqua: 256 g / 100 mL a 20 ° C.
pH
Una soluzione acquosa al 5% di acetato di potassio ha un pH di 7,5-9,0.
Altre proprietà
A volte ha un debole odore di aceto. In soluzione al 10% non aggredisce l'alluminio a temperatura ambiente ma a 60-70 ° C il metallo si scurisce e soffre di vaiolatura.
A concentrazioni del 20% o più, l'attacco superficiale sull'alluminio avviene a qualsiasi temperatura.
L'acetato di potassio (AcOK) è altamente solubile in acqua. Ha un idrato: KCH3COO.1,5HDueOppure, qual è il solido che si ottiene cristallizzandolo dalle soluzioni acquose di AcOK.
Comportamento quando riscaldato
Se l'acetato di potassio idrato (AcOK) (KCH3COO.1,5HDueO) quando raggiunge i 40 ° C inizia a perdere l'acqua di idratazione.
KCH3COO.1,5HDueO → KCH3COO + 1.5HDueOppure ↑
Se l'acetato di potassio anidro viene riscaldato (senza acqua: KCH3COO), al raggiungimento di 340 ° C inizia a decomporsi formando carbonato di potassio KDueCO3 secondo la seguente reazione:
2 KCH3COO + 4 ODue → KDueCO3 + 3 oreDueO + 3 CODue↑
Ottenere
Può essere preparato dall'azione dell'idrossido di potassio KOH su vari composti, come l'acido acetico CH3COOH, anidride acetica (CH3CO)DueO e acetato di ammonio CH3COONH4.
KOH + CH3COOH → CH3CUOCO + HDueO
Può anche essere ottenuto facendo reagire il carbonato di potassio K.DueCO3 o bicarbonato di potassio KHCO3 con acido acetico CH3COOH.
KHCO3 + CH3COOH → CH3CUOCO + HDueO + CODue↑
L'acetato di potassio può essere cristallizzato da una soluzione acquosa per ottenere un'elevata purezza.
Applicazioni
In varie applicazioni
L'acetato di potassio è utilizzato nell'industria alimentare trasformata come regolatore di acidità. Viene utilizzato come essiccante nei metodi chimici per misurare la permeabilità al vapore acqueo di alcuni tessuti..
Serve come agente disidratante per l'etanolo nella produzione di questo alcol a partire dalla lignocellulosa, un materiale derivato dal legno..
Viene utilizzato per produrre antibiotici ed è ampiamente utilizzato nelle apparecchiature antincendio.
Nell'industria dei polimeri
Viene utilizzato per riciclare i poliuretani in quanto serve a catalizzare o accelerare le reazioni di idrolisi e glicolisi di detti polimeri in modo che diventino alcoli e ammine.
Viene anche utilizzato nella produzione di resine siliconiche organiche.
Nei laboratori di ricerca scientifica e medica
L'acetato di potassio di elevata purezza viene utilizzato nei laboratori come reagente nella chimica analitica. Anche per svolgere ricerche medico-scientifiche.
Nei laboratori di istopatologia, viene utilizzato per garantire un mezzo a pH neutro nelle configurazioni del microscopio..

Viene utilizzato per la sintesi di composti organici eterociclici, che sono composti con cicli dimensionali diversi..
Alcuni microelettrodi utilizzati per studiare le proprietà elettriche delle cellule sono riempiti con una soluzione concentrata di acetato di potassio..
Nella produzione industriale di anticorpi
L'acetato di potassio viene utilizzato per la produzione su larga scala di anticorpi monoclonali (che sono quelli che provengono dalla stessa cellula staminale) nelle colture cellulari. Permette di stimolare la sintesi o la formazione di anticorpi.
Gli anticorpi sono sostanze prodotte da alcune cellule del sangue per combattere le infezioni da virus o batteri..

Nelle miscele antigelo
L'acetato di potassio è stato utilizzato nelle miscele antigelo. antigelo) al fine di utilizzarli per sciogliere il ghiaccio su strade e pavimentazioni in cemento e consentirne così un utilizzo sicuro.

La scelta dell'acetato di potassio (AcOK) per questa applicazione è dovuta al fatto che una soluzione acquosa al 50% in peso di AcOK è eutettica e ha un punto di fusione di -62 ° C. Ciò significa che anche a temperature fino a -62 ° C la soluzione rimane fusa..
Un eutettico è una miscela omogenea di componenti che ha il punto di fusione più basso di tutte le possibili miscele di questi, inclusa quella dei componenti puri..
Come funziona come antigelo
L'acetato di potassio (AcOK) ha un'ottima capacità di sciogliere il ghiaccio.
A -5 ° C è in grado di sciogliere 11,5 kg di ghiaccio per ogni kg di AcOK. Questa proprietà diminuisce al diminuire della temperatura, ma anche a -50 ° C ha la capacità di sciogliere 1,3 Kg di ghiaccio per ogni Kg di AcOH..
A -5 ° C questa capacità è paragonabile a quella del cloruro di sodio o del sale da cucina (NaCl), mentre da -30 ° C la supera di gran lunga.

Tuttavia, nelle prove effettuate con AcOK insieme ad altri composti, si è osservato un certo grado di corrosione delle superfici cementizie, per cui si è ritenuto di aggiungere agenti anticorrosivi alle miscele antigelo..
D'altra parte la miscela di acetato di potassio (CH3COOK) con formiato di potassio (HCOOK) è un ottimo antigelo e non necessita di anticorrosivo.
Riferimenti
- Baker, F.J. et al. (1976). Procedure di colorazione. Montanti acquosi. In Introduzione alla tecnologia di laboratorio medico (quinta edizione). Recupero da sciencedirect.com.
- Hassan, A.A. et al. (2018). Indazoli: sintesi ed eterociclizzazione che forma legami. In progressi nella chimica eterociclica. Recupero da sciencedirect.com.
- NOI. Biblioteca nazionale di medicina. (2019). Acetato di potassio. Recupero da pubchem.ncbi.nlm.nih.gov.
- Das, A. e Alagirusamy, R. (2010). Trasmissione dell'umidità. Metodo essiccante a tazza rovesciata. In Science in Clothing Comfort. Recupero da sciencedirect.com.
- Vargel, C. (2004). Acidi carbossilici e loro derivati. Acetati. Nella corrosione dell'alluminio. Recupero da sciencedirect.com.
- Cuevas, J. (2014). Tecniche di registrazione elettrofisiologica. Tecniche di registrazione intracellulare. Nel modulo di riferimento in scienze biomediche. Recupero da sciencedirect.com.
- Fink, J.K. (2018). Poli (uretano) s. Raccolta differenziata. Solvolysis. In Reactive Polymers: Fundamentals and Applications (Terza edizione). Recupero da sciencedirect.com.
- Fong, W. et al. (1997). Ottimizzazione della produzione di anticorpi monoclonali: effetti combinati di acetato di potassio e perfusione in un bioreattore a vasca agitata. Citotecnologia 24: 47-54. Recuperato da link.springer.com.
- Danilov, V.P. et al. (2012). Reagenti antigelo a bassa temperatura in sistemi di sale acquoso contenenti acetati e formiati. Fondamenti teorici dell'ingegneria chimica, 2012, volume 46, n. 5, pagg. 528-535. Recuperato da link.springer.com.
- Fakeev, A.A. et al. (2012). Ricerca e sviluppo di metodi per acetato di potassio di elevata purezza. Journal of Applied Chemistry, 2012, Vol.85, No.12, pagg. 1807-1813. Recuperato da link.springer.com.



Nessun utente ha ancora commentato questo articolo.